
【题目】在密闭容器中,有下列反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-93.4 kJ·mol-1,有关该反应的叙述正确的是( )
2NH3(g) ΔH=-93.4 kJ·mol-1,有关该反应的叙述正确的是( )
A. 缩小容器的体积,v(正)增大、v(逆)减小,平衡向右移动
B. 将1 mol N2和3 mol H2充分反应达到平衡时,放出的热量等于93.4 kJ
C. 催化剂能缩短该反应达到平衡所需的时间,从而提高N2的转化率
D. 若混合气体中各成分的浓度不再变化,则该反应已达平衡状态
【答案】D
【解析】A、缩小容器的体积,增大了反应体系的压强,正逆反应速率都会增大,即v(正)增大、v(逆)增大,由于正反应速率大于逆反应速率,所以平衡会向着向右移动,故A错误;B、1molN2和3molH2充分反应达到平衡状态时,由于该反应为可逆反应,生成的氨气物质的量一定小于2mol,所以放出的热量小于92.4kJ,故B错误;C、加入催化剂,能够加快反应速率,能缩短该反应达到平衡所需的时间,但是正逆反应速率增大幅度相同,正逆反应速率仍然相等,化学平衡不移动,所以不会提高N2的转化率,故C错误;D、若混合气体中各成分的浓度不再变化,说明正逆反应速率已经相等,则该反应已达到平衡状态,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境。某化学兴趣小组对废气A的组成进行探究,请回答下列问题。
(1)同学甲设计实验检验废气A中含有CO2,应选择的试剂有_________。
A.NaOH溶液 B.酸性KMnO4溶液 C.澄清石灰水 D.盐酸
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如下装置进行实验。

①为了保证实验成功,装置A应具有的现象是___________,搅拌的目的是___________。
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算。经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是_______________________________。
(3)兴趣小组的同学查阅资料发现可利用硫酸工业废气A制备皓矾(ZnSO4·7H2O)。实验模拟制备皓矾工业流程如下:

①氧化中加入硫酸铁发生反应的离子方程式是____________________。
②加入Zn粉的目的是_________________________________。
③固体A主要成分是__________________。
④操作b得到纯净皓矾晶体,必要的操作是蒸发浓缩、__________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。
回答下列问题:

(1)烧杯间填满碎纸条的作用是_____________________,大烧杯上如不盖硬纸板,求得的中和热数值_________(填“偏大”、“偏小”、“无影响”)。
(2)若用浓硫酸与NaOH溶液反应,则测得的中和热的数值会 ________(填“偏大”、“偏小”、“无影响”)。
(3)实验时所用盐酸及NaOH溶液的密度均为1g·cm3,生成溶液的比热容为:c=4.18 kJ·kg-1·℃-1,实验起始温度为t1℃,终止温度为t2℃。试计算生成1mol水时的焓变:△H=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,两个等体积的干燥圆底烧瓶中分别充满:①NH3 , ②NO2 , 进行喷泉实验.经充分反应后,瓶内溶液的物质的量浓度为( ) 
A.①>②
B.①<②
C.①=②
D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁、铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO).向反应后的溶液中加入3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加7.65g,则下列叙述中正确的是( )
A.当生成沉淀达到最大量时,消耗NaOH溶液的体积为150mL
B.当金属全部溶解时收集到NO气体的体积为0.336L(标准状况下)
C.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.6mol
D.参加反应的金属的总质量一定是9.9g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体。A、B、C、D、E、F(聚合物)和OPA的转化关系如下所示: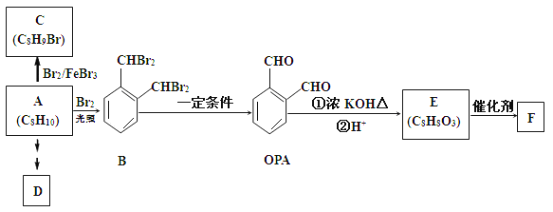
已知:![]()
回答下列问题:
(1)A的化学名称是_________________;
(2)由A生成B的反应类型是______________.在该反应的副产物中,与B互为同分异构体的化合物的结构简式为________________;
(3)写出C所有可能的结构简式_________________________________________________________;
(4)D(邻苯二甲酸二乙酯)是一种增塑剂。请用A和不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D。用结构简式表示合成路线:________________________________。
合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]()
![]()
(5)E→F的化学方程式为______________________________________________。
(6)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,G可能的同分异构体有_______种,写出核磁共振氢谱中峰面积比3∶2∶2∶1的化合物的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物在氧气中充分燃烧,生成水蒸气和二氧化碳的物质的量之比为1︰1,由此可得到结论( )
A.有机物分子中n(C):n(H):n(O)=1:2:3
B.分子中只含碳氢原子且个数比为1:2
C.有机物中必定含有氧元素
D.无法判断有机物中是否含有氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学在学习了电化学相关知识后,用如图装置进行实验,请回答下列问题:

(1)实验一:将开关K与a连接,则乙的电极反应式为___。
(2)实验二:开关K与b连接,则总反应的离子方程式为_______。
(3)对于实验二,下列说法正确的是___(填字母)。
A.溶液中Na+向甲极移动
B.从甲极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量HCl可恢复到电解前电解质的浓度
D.反应在结束后,甲电极和乙电极上收集到的气体体积一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、铁的化合物有广泛的应用。
(1)过二硫酸铵(NH4)2S2O8可以看成双氧水的衍生物,H2O2分子中的两个H原子被—SO3H基取代后即为过二硫酸。
①(NH4)2S2O8中硫元素的化合价为_________;
②用过二硫酸铵溶液检测废水中的Mn2+,配平下面的离子反应:
__S2O82-+__Mn2++__=___MnO4-+__SO42-+____。
(2)大苏打的成分是Na2S2O3·5H2O,常用于防毒面具中吸收氯气。若1 mol Na2S2O3完全反应,失去8mol电子。写出其水溶液吸收氯气的离子方程式______________。
(3)磁性材料A是由两种元素组成的化合物,某研究小组按如图所示流程探究其组成:
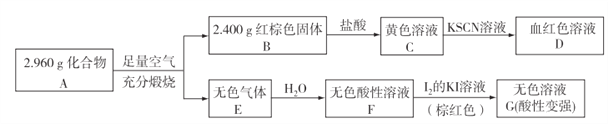
①A的化学式为____________;
②已知化合物A能与盐酸反应,生成一种淡黄色不溶物和一种气体(标准状况下密度为1.518g/L),写出该反应的离子方程式:_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com