
| A. | 稀硫酸 | B. | FeCl3溶液 | C. | CuCl2 | D. | 浓硝酸 |
分析 A.铁和稀硫酸发生置换反应;
B.铁能和铁离子发生氧化还原反应;
C.铁能和氯化铜溶液发生置换反应;
D.常温下,铁和浓硝酸发生钝化现象.
解答 解:A.在金属活动性顺序表中Fe位于H之前,所以Fe和稀硫酸发生置换反应生成氢气,故A不选;
B.铁和氯化铁溶液发生氧化还原反应生成氯化亚铁,故B不选;
C.Fe的活动性大于Cu,Fe和氯化铜溶液发生置换反应生成Cu,故C不选;
D.常温下,铁和浓硝酸发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化而发生钝化现象,故D选;
故选D.
点评 本题考查铁的性质,明确钝化概念是解本题关键,熟练掌握铁三角知识,知道铁离子、亚铁离子的检验方法,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | FeO与足量的稀硝酸反应: FeO+2H+═Fe2++H2O | 正确 |
| B | 向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO42-═BaSO4↓ | 正确 |
| C | 碳酸氢钠溶液中滴加少量的石灰水: 2HCO3-+Ca2++2OH-═CO32-+CaCO3↓+2H2O | 错误,HCO3-、OH-和H2O的系数应均为1,生成物中没有CO32- |
| D | 用食醋除去水瓶中的水垢: CaCO3+2H+═Ca2++H2O+CO2↑ | 错误,醋酸是弱酸,不应写成H+形式 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2Cr2O7的溶液中存在的平衡体系:Cr2O72-+H2O?2CrO42-+2H+ | |
| B. | 硫代硫酸钠与硫酸的离子方程式:S2O32-+2H+═SO2↑+S↓+H2O | |
| C. | KI溶液中滴加稀硫酸、双氧水:2H++2I-+H2O2═I2+2H2O | |
| D. | 用H2S沉淀硫酸铜中铜离子:S2-+Cu2+═CuS↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
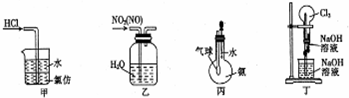
| A. | 装置甲:用于吸收HCl气体 | B. | 装置乙:用于除去NO2中的NO | ||
| C. | 装置丙:可验证氨气极易溶于水 | D. | 装置丁:可形成喷泉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
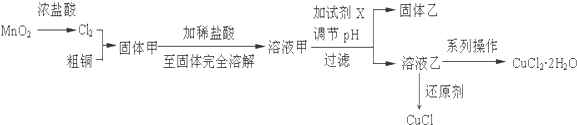

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
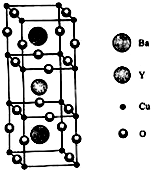 铜族元素包括Cu、Ag、Au,其单质均为面心立方晶体.
铜族元素包括Cu、Ag、Au,其单质均为面心立方晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 给定条件的有机化合物 | 同分异构体数目 |
| A | 分子式为C4H9Cl的有机物 | 3种 |
| B | 分子式为C5H10O2的一元酯 | 8种 |
| C | 分子式为C5H10的环烷烃 | 3种 |
| D | 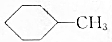 的一溴代物 的一溴代物 | 5种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com