
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | FeO与足量的稀硝酸反应: FeO+2H+═Fe2++H2O | 正确 |
| B | 向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO42-═BaSO4↓ | 正确 |
| C | 碳酸氢钠溶液中滴加少量的石灰水: 2HCO3-+Ca2++2OH-═CO32-+CaCO3↓+2H2O | 错误,HCO3-、OH-和H2O的系数应均为1,生成物中没有CO32- |
| D | 用食醋除去水瓶中的水垢: CaCO3+2H+═Ca2++H2O+CO2↑ | 错误,醋酸是弱酸,不应写成H+形式 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.稀硝酸足量,反应生成铁离子和NO气体;
B.铵根离子与氢氧根离子反应生成一水合氨;
C.石灰水少量,离子方程式按照氢氧化钙的化学式书写;
D.醋酸为弱电解质,离子方程式中不能拆开.
解答 解:A.硝酸为强氧化性酸,Fe2+会被继续氧化,正确的离子方程式为:FeO+10H++NO3-=Fe2++NO↑+5H2O,故A错误;
B.向硫酸铵溶液中加入氢氧化钡溶液,除Ba2++SO42-=BaSO4↓外,还同时发生反应NH4++OH-=NH3•H2O,故B错误;
C.由于石灰水为少量,所以参加反应的Ca2+与 2OH-的物质的量之比就应该为1:2,原离子方程式完全正确,该评价不合理,故C错误;
D.醋酸是弱酸,不应写成H+形式,评价完全正确,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑,故D正确;
故选D.
点评 本题考查了实验方案的设计与评价、离子方程式书写,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,注意本题解得关键是判断评价是否合理,为易错点.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.1 mol/L的Na2CO3溶液中加入0.01 molCH3COOH:CO32-+CH3COOH═HCO3-+CH3COO- | |
| B. | 向HCOOK和KOH的混合溶液中加入KMnO42KMnO4+HCOOK+KOH═2K2MnO4+CO2↑+H2O | |
| C. | 4 mol/L的NaAlO2溶液和7 mol/L的盐酸等体积均匀混合:4AlO2-+7H++H2O═3Al(OH)3+Al3+ | |
| D. | 在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和10mL0.1mol•L-1HAc与中和100mL0.01mol•L-1HAc所需NaOH的物质的量不同 | |
| B. | 10mL0.1mol•L-1氨水与100mL0.01mol•L-1氨水,其OH-物质的量相同 | |
| C. | 相同条件下,将pH值相同的盐酸和醋酸稀释相同的倍数,盐酸pH值变化较大 | |
| D. | 锌分别与pH=3的盐酸和pH=3的醋酸溶液反应,起始反应速率盐酸较快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | ||
| D | E | F | G |
| A. | G的最高价氧化物对应的水化物是最强的酸 | |
| B. | 熔融电解化合物D2C3可制取单质D | |
| C. | F的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物 | |
| D. | A、G分别与氢元素形成的化合物中,化学键均为极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L NH3中含氮原子数为 NA | |
| B. | 1 mol Na2O2与水完全反应时转移的电子数为NA | |
| C. | 100 mL 2.0 mol•L-1 NH4HCO3溶液中NH4+数为0.2NA | |
| D. | 1 mol O2和2 mol SO2在密闭容器中充分反应后的分子数等于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
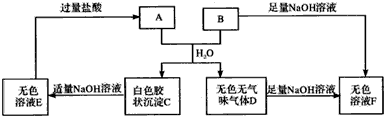
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ | |
| B. | 由C(石墨,s)═C(金刚石,s)△H=+11.9 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H不同 | |
| D. | 任何一个化学变化都伴随着能量的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com