
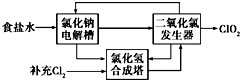
 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.分析 (1)①在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2,除去硫酸根,过量的钡离子,加入Na2CO3除去.根据提供的Ksp数据,在后面加入碳酸钠时,发生BaSO4(s)+CO32- (aq)=BaCO3(s)+SO42- (aq);
②电解饱和食盐水生成H2、Cl2和NaOH;故可以利用的单质为H2、Cl2,合成HCl,根据流程图可知加入物质为NaClO3和HCl,生成ClO2;可以写出方程式,并用化合价升降法配平得到;
(2)纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,然后配平得到;
(3)每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,故为2.5倍.
解答 解:(1)①加入过量的Na2CO3和NaOH,可分别除去Ca2+、Mg2+,在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2,除去硫酸根,过量的钡离子,加入Na2CO3除去.BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,发生BaSO4(s)+CO32- (aq)=BaCO3(s)+SO42- (aq),BaSO4(s)会部分转化为BaCO3(s),
故答案为:BaCl2;BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,BaSO4(s)会部分转化为BaCO3(s);
②电解饱和食盐水生成H2、Cl2和NaOH;故可以利用的单质为H2、Cl2,合成HCl,根据流程图可知加入物质为NaClO3和HCl,生成ClO2;发生氧化还原反应,NaClO3被还原生成ClO2,HCl被氧化生成Cl2,同时生成水,反应的化学方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,
故答案为:H2、Cl2;2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O;
(2)纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,则配平后的化学方程式为 C6H12O6+24 NaClO3+12H2SO4=24 ClO2↑+6 CO2↑+18H2O+12 Na2SO4,
故答案为:1;C6H12O6;24;6;12Na2SO4;
(3)每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的2.5倍,故答案为:2.5.
点评 本题考查混合物分离提纯实验,为高频考点,涉及氧化还原反应相关概念、配平及计算,化学实验基本方法(除杂)等相关知识,题目难度中等,注意把握物质的分离、提纯操作方法.


科目:高中化学 来源: 题型:实验题
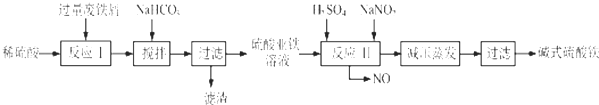
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(CO2)=v(CO) | B. | 容器中总压强不变 | ||
| C. | 容器中混合气体的密度不变 | D. | 各组分浓度不再随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
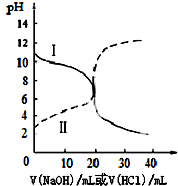 25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用浓度均为0.1mol•L-1NaOH溶液和盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用浓度均为0.1mol•L-1NaOH溶液和盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )| A. | 曲线Ⅰ:滴加溶液到20 mL时溶液的pH=5则:c(H+)-c((NH3•H2O)=c(OH-)=1×10-9 mol•L-1 | |
| B. | 曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| D. | 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HC1O | |
| B. | NH4HSO3溶液与足量NaOH溶液反应:NH4++OH-═NH3↑+H2O | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 将1 mol•L-1NaAlO2溶液和1.5 mol•L-1的HC1溶液等体积混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
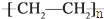 )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉在空气中易变质,所以应密封保存 | |
| B. | 工业上可用铁质容器存放浓硫酸 | |
| C. | 液氯可储存在钢瓶中,便于运输和使用 | |
| D. | 硅酸钠的水溶液俗称“水玻璃”,可保存在带玻璃塞的细口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| B. | 2.24 L CO2中含有的原子数为0.3×6.02×1023 | |
| C. | 200 mL 5 mol•L-1 Na2CO3溶液中,含6.02×1023个CO32- | |
| D. | 4.5gSiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com