
分析 根据金属氧化物与酸反应生成盐和水,写出相应的化学方程式;根据三价铁离子溶液黄色;
(1)向FeCl3溶液中滴入NaOH溶液,二者之间会发生复分解反应;
(2)根据Fe(OH)3胶体的制法:向沸水中滴加饱和的氯化铁溶液;
(3)根据丁达尔效应区分胶体和溶液;
(4)硫酸为电解质溶液.加入胶体中引起胶体聚沉,生成氢氧化铁沉淀,继续加入硫酸会溶解氢氧化铁得到黄色溶液.
解答 解:Fe2O3粉末(红棕色)加入适量盐酸,反应的化学方程式为:Fe2O3 +6HCl=2FeCl3 +3H2O,所得溶液中含有Fe3+离子,溶液呈黄色,
故答案为:Fe2O3+6HCl=2FeCl3+3H2O;?
(1)向FeCl3溶液中滴入NaOH溶液发生复分解反应:FeCl3+3NaOH═3NaCl+Fe(OH)3↓,
故答案为:FeCl3+3NaOH═3NaCl+Fe(OH)3↓;复分解反应;
(2)Fe(OH)3胶体的制法:向沸水中滴加饱和的氯化铁溶液,直到出现红褐色胶体为止,故答案为:红褐;
(3)胶体乙可发生丁达尔效应,而溶液不能,利用这一点可以区分胶体和溶液,故答案为:乙;胶体和溶液;
(4)向Fe(OH)3胶体中滴入过量稀硫酸,胶体先发生聚沉生成红褐色沉淀,继续加入沉淀会溶解,反应的化学方程式为:Fe(OH)3+3HCl=FeCl3+3H2O,
故答案为:先出现红褐色沉淀后沉淀溶解.
点评 本题考查学生Fe(OH)3胶体的性质、制备以及胶体和溶液的鉴别等知识,注意知识的迁移和应用是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
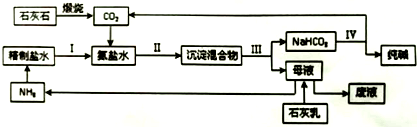
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
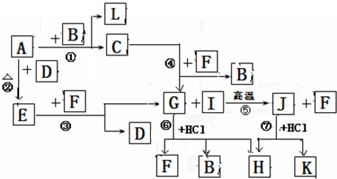
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
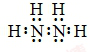 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
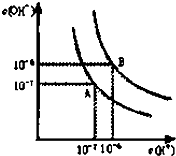 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.体积为5L的恒温、恒容密闭容器甲起始投入2molN2、3molH2经过l0s达平衡,测得平衡时NH3的物质的量为0.8mol.
Ⅰ.体积为5L的恒温、恒容密闭容器甲起始投入2molN2、3molH2经过l0s达平衡,测得平衡时NH3的物质的量为0.8mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| v(mol•L-1•s-1) | c(H2)(mol•L-1) | c(Cl2)(mol•L-1) |
| 1.0k | 1.0 | 1.0 |
| 2.0k | 2.0 | 1.0 |
| 4.0k | 2.0 | 4.0 |
| A. | m=1,n=1 | B. | m=$\frac{1}{2}$,n=$\frac{1}{2}$ | C. | m=$\frac{1}{2}$,n=1 | D. | m=1,n=$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用pH计测定0.1mol/L氨水的pH | |
| B. | 用pH试纸测定0.1mol/LNH4Cl溶液的pH | |
| C. | 将氨水连接在一个带灯泡的通电电路中,观察灯泡亮度 | |
| D. | 等浓度、等体积的氨水和NaOH分别与等浓度的盐酸反应,比较消耗盐酸体积的多少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com