
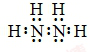 .
.分析 (1)N2H4是氮原子和氢原子形成四个共价键,氮原子和氮原子间形成一个共价键形成的共价化合物,元素化合价代数和为0计算化合价;
(2)①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
依据热化学方程式和盖斯定律计算③×2-②×2-①得到④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=-1048.9kJ•mol-1;根据联氨和N2O4的反应特点分析;
(3)结合氨气在溶液中的电离特点可知第一步电离出N2H5+、OH-,据此写出联氨第一步电离方程式.
解答 解:(1)肼的分子式为N2H4,是氮原子和氢原子形成四个共价键,氮原子和氮原子之间形成一个共价键形成的共价化合物,其电子式为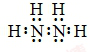 ,
,
故答案为: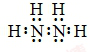 ;
;
(2)①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
依据热化学方程式和盖斯定律计算③×2-②×2-①得到④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=2△H3-2△H2-△H1,根据反应④可知,联氨和N2O4反应放出大量热且产生大量气体,因此可作为火箭推进剂,
故答案为:2△H3-2△H2-△H1;反应放热量大,产生大量气体;
(3)联氨为二元弱碱,在水中的电离方式与氨相似,其第一步电离出N2H5+、OH-,联氨第一步电离方程式为:N2H4+H2O?N2H5++OH-,
故答案为:N2H4+H2O?N2H5++OH-.
点评 本题考查较为综合,涉及热化学方程式的计算、电离方程式、电子式的书写等知识,题目难度中等,明确盖斯定律的内容为解答关键,注意掌握电离方程式的书写原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.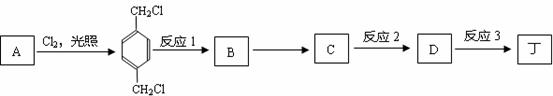
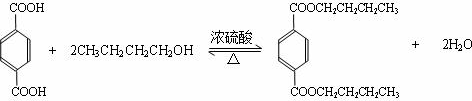 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定熔融氢氧化钠的导电性,将氢氧化钠固体放在石英坩埚中加热熔化 | |
| B. | 将一定量的Na2O2和NaHCO3的混合物放在一密闭容器中充分加热后,所得固体中一定含有Na2CO3 | |
| C. | 硫酸、纯碱、偏铝酸钠和过氧化钠分别属于酸、碱、盐和氧化物 | |
| D. | 将足量的稀盐酸加到Mg、AlCl3、NaAlO2组成的混合物中,只能发生一种反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(CO2)=v(CO) | B. | 容器中总压强不变 | ||
| C. | 容器中混合气体的密度不变 | D. | 各组分浓度不再随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HC1O | |
| B. | NH4HSO3溶液与足量NaOH溶液反应:NH4++OH-═NH3↑+H2O | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 将1 mol•L-1NaAlO2溶液和1.5 mol•L-1的HC1溶液等体积混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用带橡皮塞的棕色试剂瓶存放浓硝酸 | |
| B. | 容量瓶、分液漏斗使用前均需检查是否漏水 | |
| C. | 分液漏斗分液时,必须先将下层液体从下口放出,再将上层液体从上口倒出 | |
| D. | 蒸馏时,需将温度计的水银球没入液面以下且不接触烧瓶壁 | |
| E. | 氨气喷泉实验时,收集气体的烧瓶必须干燥 | |
| F. | 用玻璃棒蘸取待测液,点在润湿的pH试纸上测定其pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com