
【题目】在半导体工业中有这样一句话:“从沙滩到用户”,其中由粗硅制纯硅的常用方法为:Si(粗)+2Cl2=SiCl4SiCl4+2H2=Si(纯)+4HCl。
若在25℃、101kPa条件下反应生成HCl气体49L,(注:25℃、101kPa条件下气体摩尔体积为24.5Lmol-1)则:
(1)反应生成HCl气体的质量为__,转移电子的总数为___。
(2)反应生成的HCl气体溶于127mL水中,得到密度为1.20gmL-1的盐酸,此盐酸的物质的量浓度为___。
(3)“从沙滩到用户”涉及多个反应,其中制取粗硅的反应方程式为___。纯净的石英与烧碱反应可以制得水玻璃,反应的离子方程式为__。
(4)普通玻璃若以氧化物形式表示其组成为(质量分数):Na2O13%,CaO11.7%,SiO275.3%。现以石灰石、纯碱和石英为原料生产这种玻璃10t,石灰石的利用率为80%,纯碱和石英的利用率为95%,至少需耍上述原料的质量是___t。(保留两位小数)
【答案】73g 4NA 12mol·L-1 SiO2+2C![]() Si(粗)+2CO↑ SiO2+2OH-=SiO32-+H2O 12.88
Si(粗)+2CO↑ SiO2+2OH-=SiO32-+H2O 12.88
【解析】
(1)n=![]() =2mol,m=n×M=2mol×36.5g·mol-1=73g;
=2mol,m=n×M=2mol×36.5g·mol-1=73g;
根据方程式:
 可知,反应生成2mol氯化氢消耗1mol氯气和1mol氢气,共转移电子的物质的量为:1mol×2+1mol×2=4mol,故转移电子个数为4NA;
可知,反应生成2mol氯化氢消耗1mol氯气和1mol氢气,共转移电子的物质的量为:1mol×2+1mol×2=4mol,故转移电子个数为4NA;
故答案为:73g;4NA;
(2)V=![]() =
=![]() mL=
mL=![]() ×10-3L,C=
×10-3L,C=![]() =
=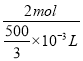 =12mol·L-1;故答案为:12mol·L-1;
=12mol·L-1;故答案为:12mol·L-1;
(3)焦炭与SiO2反应生成Si与CO,反应方程式为:SiO2+2C![]() Si+2CO↑;二氧化硅和氢氧化钠反应生成硅酸钠和水,反应的化学方程式为:2NaOH+SiO2═Na2SiO3+H2O,离子方程式为:2OH-+SiO2═SiO32-+H2O;
Si+2CO↑;二氧化硅和氢氧化钠反应生成硅酸钠和水,反应的化学方程式为:2NaOH+SiO2═Na2SiO3+H2O,离子方程式为:2OH-+SiO2═SiO32-+H2O;
故答案为:SiO2+2C![]() Si+2CO↑;2OH-+SiO2═SiO32-+H2O;
Si+2CO↑;2OH-+SiO2═SiO32-+H2O;
(4)每天10t,其中含有Na2O质量10t×13%=1.3t,CaO质量10t×11.7%=1.17t,SiO2质量10t×75.3%=7.53t,而Na2O都是从Na2CO3中来,CaO都是从CaCO3中来,SiO2都是从石英中来,根据质量守恒可知设需要石灰石CaCO3质量x,纯碱Na2CO3质量y,石英SiO2质量z,则 80%x×=1.17t,即 80%x×![]() =1.17t,解得x≈2.61,95%y×
=1.17t,解得x≈2.61,95%y×![]() =1.3t,即95%y×
=1.3t,即95%y×![]() =1.3t,解得y≈2.34t,95%z=7.53t,解得z≈7.93t,∴共需原料:2.61t+2.34t+7.93t=12.88t;
=1.3t,解得y≈2.34t,95%z=7.53t,解得z≈7.93t,∴共需原料:2.61t+2.34t+7.93t=12.88t;
故答案为:12.88。


科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)![]() Z(g)(正反应为放热反应)该反应经过60 s时,生成0.3 mol Z,下列说法正确的是( )
Z(g)(正反应为放热反应)该反应经过60 s时,生成0.3 mol Z,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.01 mol·(L·s)-1
B.反应经过60 s时一定能达到化学平衡
C.反应放出的热量可用于提高反应速率
D.反应达到平衡时,n(X):n(Y)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 18g氨基(-ND2)中含有的电子数为10NA
B. 一定质量的乙烷与22.4L(标准状况)Cl2在光照条件下发生取代反应,形成C-Cl键的数目为2NA
C. 用惰性电极电解100mL0.1mol·L-1的CuSO4溶液,当阴、阳两极产生相同条件下等体积的气体时,电路中转移电子数为0.04NA
D. n(H2SO3)和n(HSO3-)之和为1mol的KHSO3溶液中,含有的K+数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl溶于水配成1 mol·L-1的溶液,溶解过程如图所示,下列说法正确的是

A. a离子为Na+
B. 溶液中含有NA个Na+
C. 水合b离子的图示不科学
D. 室温下测定该NaCl溶液的pH小于7,是由于Cl-水解导致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定有机物A的结构,某研究团队对有机物A进行了多项实验,得实验结果如下:
①有机物A经李比希法分析知:含碳77.8%,氢为7.40%,其余为氧;
②质谱法分析A得知其相对分子质量为108;
③经红外光谱测定,A分子结构中含有苯环和羟基;
④A的核磁共振氢谱显示其有4种峰,且峰面积比为3∶2∶2∶1;
⑤A为无色晶体,常温下微溶于水;能与烧碱反应,且在常温下A可与浓溴水反应,1 mol A最多可消耗浓溴水中2 mol Br2。
求:(1)该有机物的分子式为________________。
(2)确定该有机物的结构简式:___________________,写出其与足量浓溴水反应的化学方程式:__________。
(3)含有苯环的A的同分异构体还有____________种(不含A),请写出其中属于醇的同分异构体与氧气加热(铜作催化剂)的反应方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 18 g D2O所含的电子数为10NA
B. 1 mol H2O2中含有极性键的数目为3NA
C. 标准状况下,22.4 L四氯化碳所含分子数为NA
D. 32g O2和O3的混合物中含有的氧原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中键角由大到小排列的是
①BCl3 ②NH3 ③H2O ④PCl4+ ⑤BeCl2
A. ⑤④①②③ B. ④①②⑤③ C. ⑤①④②③ D. ③②④①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HA的电离常数Ka=1×10-6,向20 mL浓度为0.01 mol·L-1的HA溶液中逐滴加入0.01mol·L-1的NaOH溶液,溶液的pH与加入NaOH溶液的体积之间的关系如图所示,下列说法正确的是( )

A.a点对应溶液的pH约为4,且溶液中只存在HA的电离平衡
B.b点对应溶液中:c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
C.d点对应溶液中:c(OH-)-c(H+)=c(A-)
D.a、b、c、d四点对应的溶液中水的电离程度:a<b<c<d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知

A. X、Y、Z中最简单氢化物稳定性最弱的是Y
B. Z元素氧化物对应水化物的酸性一定强于Y
C. X元素形成的单核阴离子还原性大于Y
D. Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com