
【题目】常温下,HA的电离常数Ka=1×10-6,向20 mL浓度为0.01 mol·L-1的HA溶液中逐滴加入0.01mol·L-1的NaOH溶液,溶液的pH与加入NaOH溶液的体积之间的关系如图所示,下列说法正确的是( )

A.a点对应溶液的pH约为4,且溶液中只存在HA的电离平衡
B.b点对应溶液中:c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
C.d点对应溶液中:c(OH-)-c(H+)=c(A-)
D.a、b、c、d四点对应的溶液中水的电离程度:a<b<c<d
【答案】D
【解析】
A.a点为0.01 mol·L-1的HA溶液,此时溶液中存在HA和H2O的电离平衡,故A错误;
B.b点为在20mL0.01 mol·L-1的HA溶液中滴加10mL0.01 mol·L-1的NaOH溶液,此时溶液中NaH和HA等物质的量混合,溶液pH<7,说明HA的电离程度大于A-的水解程度,则c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-),故B错误;
C.d点为滴加20mLNaOH溶液,此时恰好完全中和生成NaA,溶液中存在的电荷守恒式为c(OH-)+c(A-)=c(H+)+c(Na+),物料守恒式为c(Na+)=c(A-)+c(HA),则c(OH-)-c(H+)=c(HA)<c(A-),故C错误;
D.a点为HA溶液,b点是HA和NaA等浓度的混合溶液,c点是NaA和少量HA的混合液且溶液pH=7,d点是NaA的溶液,酸、碱溶液都抑制了水的电离,NaA促进水的电离,且所含NaA的浓度越大,溶液中水的电离程度越大,则a、b、c、d四点对应的溶液中水的电离程度:a<b<c<d,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管桩,常用下图的方法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )
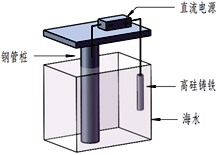
A. 该保护方法称为外加电流的阴极保护法
B. 通电后外电路电子被强制从高硅铸铁流向钢管柱
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在半导体工业中有这样一句话:“从沙滩到用户”,其中由粗硅制纯硅的常用方法为:Si(粗)+2Cl2=SiCl4SiCl4+2H2=Si(纯)+4HCl。
若在25℃、101kPa条件下反应生成HCl气体49L,(注:25℃、101kPa条件下气体摩尔体积为24.5Lmol-1)则:
(1)反应生成HCl气体的质量为__,转移电子的总数为___。
(2)反应生成的HCl气体溶于127mL水中,得到密度为1.20gmL-1的盐酸,此盐酸的物质的量浓度为___。
(3)“从沙滩到用户”涉及多个反应,其中制取粗硅的反应方程式为___。纯净的石英与烧碱反应可以制得水玻璃,反应的离子方程式为__。
(4)普通玻璃若以氧化物形式表示其组成为(质量分数):Na2O13%,CaO11.7%,SiO275.3%。现以石灰石、纯碱和石英为原料生产这种玻璃10t,石灰石的利用率为80%,纯碱和石英的利用率为95%,至少需耍上述原料的质量是___t。(保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的+1价离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。下列说法错误的是
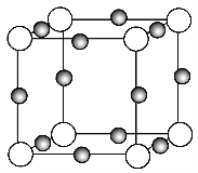
A. X元素的原子序数是19 B. X的晶体具有良好的导电性、导热性和延展性
C. X+离子是图中的黑球 D. 该晶体中阳离子与阴离子个数比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. 金属Mg(六方最密堆积)和金属Cu(面心立方最密堆积)的空间利用率
B. BF3和CH4中心原子的价层电子对数
C. Si-O和C-O的键能
D. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入3mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mLB.75 mLC.80 mLD.100 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 下列实验方案合理的是________。
A.配制银氨溶液:在一定量AgNO3溶液中,滴加氨水至沉淀恰好溶解
B.在检验醛基配制Cu(OH)2悬浊液时,在一定量CuSO4溶液中,加入少量NaOH溶液
C.验证RX为碘代烷,把RX与烧碱水溶液混合加热,将溶液冷却后再加入硝酸银溶液
D.无水乙醇和浓硫酸共热到170 ℃,将制得的气体通入酸性高锰酸钾,可检验制得的气体是否为乙烯
E.乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷
F.除去混在苯中的少量苯酚,加入过量溴水,过滤
G.实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度
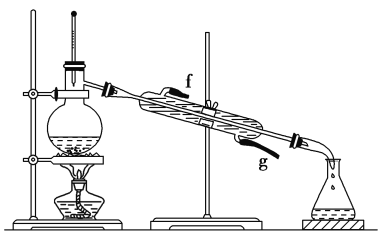
II.某化学小组采用类似制乙酸乙酯的装置(如下图),以环己醇制备环己烯。
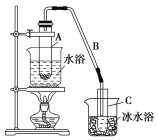
已知: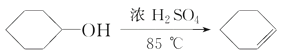 +H2O
+H2O
密度(g·cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品:
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是________________,②导管B除了导气外还具有的作用是__________。
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________(填“上”或“下”)层,分液后用______(填编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从________(填“f”或“g”)口进入。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用Na2S沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列说法不正确的是( )
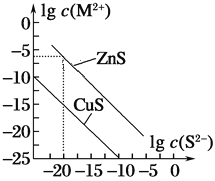
A.向Cu2+浓度为1×10-5 mol·L-1的工业废水中加入ZnS粉末,会有CuS沉淀析出
B.25 ℃时,Ksp(CuS)约为1×10-35
C.向100 mL Zn2+、Cu2+浓度均为1×10-5 mol·L-1的混合溶液中逐滴加入1×10-4 mol·L-1的Na2S溶液,Cu2+先沉淀
D.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃X和一种气态烯烃Y组成的混合物10g,其密度为相同条件下氢气密度的12.5倍,该混合气体通过溴水,使溴水增重8.4g,则X,Y可能是( )
A. 甲烷和丙烯B. 甲烷和乙烯C. 乙烷和乙烯D. 乙烯和丙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com