
| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | NO2与水反应氧化剂与还原剂物质的量比为2:1 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 铁露置在空气中一段时间后会生锈;性质更活泼的铝不能稳定存在于空气中 |
分析 A.酸性氧化物能够与碱反应只生成盐和水;
B.依据方程式3NO2+H2O=2HNO3+NO中氮元素化合价变化判断;
C.一氧化氮与氧气反应生成二氧化氮;
D.金属铁在空气中因发生电化学腐蚀而生锈,金属铝和氧气反应生成致密氧化膜.
解答 解:A.二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,属于酸性氧化物,故A正确;
B.该反应中N元素的化合价由+4价变为+5价和+2价,所以生成硝酸的二氧化氮是还原剂,其计量数是2,生成NO的二氧化氮是氧化剂,其计量数是1,所以氧化剂和还原剂的物质的量1:2,故B错误;
C.一氧化氮与氧气反应生成二氧化氮,在空气中不能稳定存在,故C错误;
D.金属铁在空气中因发生电化学腐蚀而生锈,金属铝和氧气反应生成致密氧化膜,能阻止了腐蚀,故D错误;
故选:A.
点评 本题考查了元素化合物知识,熟悉二氧化硅、二氧化氮、一氧化氮、铝的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 溴化银应避光保存 | |
| B. | 变色镜片可反复变色 | |
| C. | 变色镜片颜色变深的过程发生了化合反应 | |
| D. | 变色镜片中的氧化铜在变色过程中质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑥>⑤>④>①>③>② | B. | ⑥>④>⑤>①>③>② | C. | ⑥>④>⑤>①>②>③ | D. | ⑥>⑤>④>①>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的结构示意图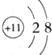 | |
| B. | 聚乙烯的结构简式为CH2=CH2 | |
| C. | 纯碱的化学式为Na2CO3 | |
| D. | 高氯酸(HClO4)中氯元素的化合价为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该分子中官能团的名称为羧基、羟基,可以和醇类物质发生酯化(或取代)反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为HOOC-CH=CH-COOH.
,该分子中官能团的名称为羧基、羟基,可以和醇类物质发生酯化(或取代)反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为HOOC-CH=CH-COOH.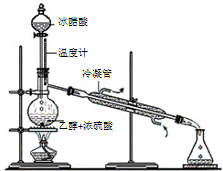

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
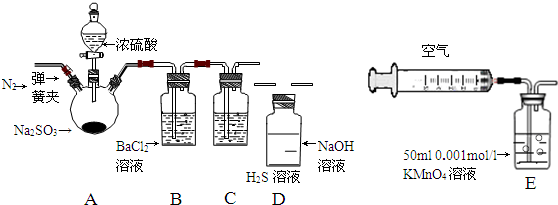
| 实验步骤 | 实验操作 | 预期现象与结论 |
| 1 | 取少量溶液于试管,滴入几滴酚酞 | 溶液变红 |
| 2 | 然后加入足量的BaCl2溶液 | 溶液中产生白色沉淀,最后若红色褪去,则说明①正确;若红色不能褪去,则说明②正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com