
����Ŀ����ˮ��������Ȼ���������ص��ƻ����ã�������ˮ��Ⱦ�����̲��ݻ���
��1��ij�����������ķ�ˮ�к���Fe2����Mn2+�Ƚ������ӣ����ù������[(NH4)2S2O8]������ȥ��
�ٹ��������Mn2+��Ӧ����MnO2�����ӷ���ʽΪ________________��
���¶���Fe2+��Mn2+�����̶�֮��Ĺ�ϵ��ͼ1��ʾ��

ͼ1
ʵ�������Ӧ���¶ȿ�����________________��Fe2+��Mn2+���������γɽ�����״���ӣ����������̿�������������̿��Ŀ��Ϊ________________��
��H2O2Ҳ�н�ǿ�����ԣ���ʵ�������в���H2O2����Mn2+��ԭ����________________��
��2������ij����ɸ��������NH3���ѳ�������NO��NO2���䷴Ӧ������ͼ2��ʾ��A�������ʵĻ�ѧʽΪN2��________________��


ͼ2 ͼ3
��3����ҵ�Ϸ�����SO2����Na2CO3��Һ���գ���Ӧ��������Һ��ɱ仯��ͼ3��ʾ��
�����ճ��ڣ�ͼ��A����ǰ����Ӧ�Ļ�ѧ����ʽΪ________________��
��C�����B���ԭ����________________��
���𰸡� S2O82�� + 2H2O + Mn 2��=4H�� + 2SO42�� + MnO2�� 80����80��~90����������� �������������γɳ��� �̵Ļ�����ɴ�H2O2�ķֽ���ʹ���ĵ�H2O2���� H2O 2Na2CO3 + SO2 + H2O��2NaHCO3 + Na2SO3 ������Ԫ���غ��� NaHSO3�����ʵ�����Na2CO3��2��������NaHSO3�������������������ʹ�
����������1���ٹ��������Mn2+��Ӧ����MnO2������������ԭΪSO42������Ӧ�����ӷ���ʽΪS2O82�� + 2H2O + Mn 2��=4H�� + 2SO42�� + MnO2�����ڸ���ͼ1��֪��80��ʱFe2+��Mn2+�����̶Ƚӽ�1.0����ʵ�������Ӧ���¶ȿ�����80����Fe2+��Mn2+���������γɽ�����״���ӣ����������̿�������������̿��Ŀ��Ϊ�������������γɳ�������H2O2Ҳ�н�ǿ�����ԣ���ʵ�������в���H2O2����Mn2+��ԭ�����̵Ļ�����ɴ�H2O2�ķֽ���ʹ���ĵ�H2O2���ࣻ��2������ͼʾ��Ӧ�ɲ���A�ķ�ӦΪ��[��NH4����HNO2��]+=N2+A+H+����Ϸ�Ӧ���Ƶ���AΪH2O����ӦΪ[��NH4����HNO2��]+=N2+ 2H2O +H+����3�������ճ��ڣ�ͼ��A����ǰ����ҵ�Ϸ�����SO2����Na2CO3��Һ���գ���ͼ����Ϣ��֪��NaHCO3 ��Na2SO3�����������ӣ�������Ӧ�Ļ�ѧ����ʽΪ��2Na2CO3 + SO2 + H2O��2NaHCO3 + Na2SO3����C�����B���ԭ���Ǹ�����Ԫ���غ��� NaHSO3�����ʵ�����Na2CO3��2��������NaHSO3�������������������ʹ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������й����θ�д�����������ʽ����дʱע�������������ǰ���ǽ����������ںͼ���ǰ�����ں�
��þ���ʯ��Mg2SiO4��____________��
�ڸ���ʯAl2��Si2O5����OH��4____________��
��2����ȥͭ�����ͭ��[Cu��OH��2CO3]ѡ���Լ�____________����Ӧ����ʽΪ____________��
��3����![]() �У�____________��____________��Ϊͬλ�أ�_____��________��������ȣ�����________��ԭ�ӣ�����________��Ԫ�ء�
�У�____________��____________��Ϊͬλ�أ�_____��________��������ȣ�����________��ԭ�ӣ�����________��Ԫ�ء�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ��10 g ����ͭ��ĩ����Ƭ������ȴ��ʣ����������Ϊ8.4 g�����м�����ȷ����
A. ��1.6 g ˮ����
B. ��8.4 g ͭ����
C. ��80%������ͭ����ԭ
D. ʵ��ʱ�����ĵ���������0.2 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�S8��s����O2��g��������Ӧ����ת��ΪSO2��g����SO3��g������֪��2SO2+O2![]() 2SO3������Ӧ�����е�������ϵ������ͼ��ʾ��ͼ�еġ�H ��ʾ����1mol��������ݣ��� ����˵����ȷ���ǣ�������
2SO3������Ӧ�����е�������ϵ������ͼ��ʾ��ͼ�еġ�H ��ʾ����1mol��������ݣ��� ����˵����ȷ���ǣ�������

A. S8��ȼ���ȡ�H=��a kJ��mol��1
B. 1 mol SO2���� O2��Ӧ���ͷų� b kJ ������
C. ��֪1��S8��������8��S��S��S=O�ļ���Ϊd kJ��mol��1��O=O�ļ���Ϊe kJ��mol��1����S8������S��S�ļ���Ϊ��2d��a��e�� kJ��mol��1
D. ��ʹ��V2O5����������SO2��g��ת������1mol SO3��g��ʱ���ͷŵ�����С��b kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z������ԭ��������������Ķ�����Ԫ�ء�a��b��c��d��e������ЩԪ����ɵĻ��������a��ˮ��Һ�ʼ��ԣ�cΪ����ɫ���壬e����W��Y��ZԪ���γɵĻ����mΪԪ��Y�γɵĵ��ʡ��������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ����
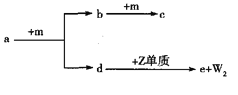
A. �����Ӱ뾶��Z>Y B. ����̬�⻯����ȶ��ԣ�X>Y
C. eΪ���ӻ�����������Ӽ����ۼ� D. W��X��Y�γɵĻ����ﲻ���������ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڣ�Te)�ĵ��ʺͻ������ڻ��������ȷ��������ҪӦ�á�
(1)���й����ڼ��仯�������������ȷ����_______��
A.Teλ��Ԫ�����ڱ��ĵ���������A��
B. Te��������ͨ����TeO2��TeO3
C. H2TeO4�����Ա�H2SO4����ǿ
D.���ȶ���H2Te��H2S����H2Te��HIǿ
(2)25��ʱ�������ᣨH2TeO3)�� ![]() = 1��10-3,
= 1��10-3, ![]() =2��10-8��0. 1 mol . L-1H2TeO3 �ĵ���� a ԼΪ___________ (
=2��10-8��0. 1 mol . L-1H2TeO3 �ĵ���� a ԼΪ___________ (![]() ); NaHTeO3����Һ��pH_______7(������������=��������������
); NaHTeO3����Һ��pH_______7(������������=��������������
(3)TeO2����ˮ�������ڽ�Ũ��ǿ���ǿ���ҵ�ϳ���ͭ�����ࣨ��Ҫ����TeO2������Ag��Au)Ϊԭ���Ʊ������ڣ��乤���������£�

���������ʱTeO2������Ӧ�Ļ�ѧ����ʽΪ _________��
����������ʱ������Һ��pHΪ4. 5��5. 0,����Tea���������Բ��ܹ�ǿ��ԭ����_________����ֹ�ֲ���ȹ���IJ���������____________��
������������SO2ͨ��TeCl4������Һ�н�������ԭ���õ��ڣ��÷�Ӧ�Ļ�ѧ����ʽ��____________��
����ҵ�ϻ�����ͨ�����ͭ�������������˺����Һ�õ������ڡ���֪���ʱ�ĵ缫��Ϊʯī���������ĵ缫��ӦʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���10mL0.1mol��![]() ��HA��Һ����ε���0.1mol��
��HA��Һ����ε���0.1mol��![]() ��ROH��Һ��������ҺpH�����������ı仯��ͼ�������ж���ȷ����
��ROH��Һ��������ҺpH�����������ı仯��ͼ�������ж���ȷ����
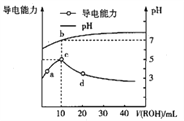
A. ROH����Һ�еĵ��뷽��ʽΪ![]()
B. c����![]() �������
�������![]() Ũ����С
Ũ����С
C. b����ڣ� ![]()
D. �������¶ȣ�a��d����pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�¶��£������Ϊ1L�����������ܱ������з������淴Ӧ��N2��g��+3H2��g��![]() 2NH3��g����H=һ92kJ/mol��ʵ������ʼ��ƽ��ʱ���й��������±���
2NH3��g����H=һ92kJ/mol��ʵ������ʼ��ƽ��ʱ���й��������±���

����������������
A�������١����з�Ӧ��ƽ�ⳣ�����
B��ƽ��ʱ������������NH3�����������Ϊ1/3
C���������д�ƽ��ʱ�ų�������Q��46 kJ
D�������������Ϊ2L����ƽ��ʱ�ų���������46kJ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com