
【题目】相同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g)△H=一92kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=一92kJ/mol。实验测得起始、平衡时的有关数据如下表:

下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/3
C.容器②中达平衡时放出的热量Q=46 kJ
D.若容器①体积为2L,则平衡时放出的热量<46kJ
【答案】C
【解析】
试题分析:A、平衡常数只与温度有关,相同温度下,体积均为1L的两个恒容密闭容器中发生相同的反应,则平衡常数应相同,A正确;B、①容器中放出46kJ热量,则消耗的氨气的物质的量为:![]() =0.5mol,则根据方程式可知
=0.5mol,则根据方程式可知
N2(g)+3H2(g)![]() 2NH3(g)△H=一92kJ/mol
2NH3(g)△H=一92kJ/mol
起始量(mol)1 3 0
转化量(mol)0.5 1.5 1
平衡量(mol)0.5 1.5 1
平衡时,①容器中NH3的体积分数等于气体的物质的量分数=![]() ,从等效平衡的角度分析,0.9molN2、2.7molH2和0.2molNH3相当于1molN2、3molH2,在相同条件下处于相同平衡状态,所以平衡时两个容器内氨气的体积分数相等,B正确;C、②中含有0.2molNH3相当在①的基础上加入氨气,抑制平衡正向移动,则平衡时放出的热量小于46kJ,C错误;D、若容器①体积为2L,相当于在原来的基础上减小压强,平衡逆向移动,平衡时放出的热量小于46kJ,D正确,答案选C。
,从等效平衡的角度分析,0.9molN2、2.7molH2和0.2molNH3相当于1molN2、3molH2,在相同条件下处于相同平衡状态,所以平衡时两个容器内氨气的体积分数相等,B正确;C、②中含有0.2molNH3相当在①的基础上加入氨气,抑制平衡正向移动,则平衡时放出的热量小于46kJ,C错误;D、若容器①体积为2L,相当于在原来的基础上减小压强,平衡逆向移动,平衡时放出的热量小于46kJ,D正确,答案选C。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为________________。
②温度与Fe2+、Mn2+氧化程度之间的关系如图1所示:

图1
实验过程中应将温度控制在________________。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为________________。
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是________________。
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图2所示。A包含物质的化学式为N2和________________。


图2 图3
(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图3所示。
①吸收初期(图中A点以前)反应的化学方程式为________________。
②C点高于B点的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】遇到下列情况时,其处理方法有误的是( )
A.将CO中毒者转移到通风处抢救
B.皮肤上不慎沾有浓碱液,立即用大量水冲洗,然后涂上2% 的硼酸溶液
C.少量酒精失火时,立即用湿抹布盖灭
D.夜间进入厨房,闻到很浓的煤气味,立即开灯检查
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验选用的用品一定不需要的是( )
A.碳酸钠溶液pH值测定(pH试纸)B.粗盐提纯(蒸发皿)
C.蒸馏自来水制蒸馏水(冷凝管)D.硝酸钾与食盐的分离(分液漏斗)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
![]()
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是 。
【设计、完成实验】(1)称取 g草酸晶体(H2C2O4·2H2O),配置500 mL 0.10 mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和 。
②下列操作会使所配溶液浓度偏低的是 (填下列选项的字母序号)。
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
B.定容时俯视刻度线 |
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
实验 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
0.10 mol/L | 等浓度 | H2O | 0.50 mol/L | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度65 ℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/LK2SO4溶液 | 18 |
则x = ,假设2成立
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10 mol/L H2C2O4溶液于锥形瓶中,加入10 mL 0.50 mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为: 。上述实验中KMnO4溶液的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 t℃时, Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知 AgCl 的Ksp=1.8×10-10。下列说法不正确的是( )
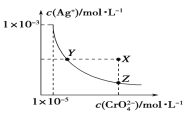
A. t℃时,Ag2CrO4的 Ksp为 1×10-8
B. t℃时,Y 点和Z点时 Ag2CrO4的 Ksp 相等
C. t℃时,Ag2CrO4、AgCl 饱和溶液中,前者 c(Ag+)大
D. 饱和 Ag2CrO4 溶液中加 K2CrO4 不能使溶液由 Y点变为 X点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com