
����Ŀ������(H2C2O4)��Һ������KMnO4��Һ��Ӧʱ����Һ��ɫ����������죬ijѧϰС��̽����Ӧ������ʹ��ɫ�ӿ����Ҫԭ��������:
���������ϡ�KMnO4��Һ����H2C2O4�ķ�Ӧ����Ϊ��
![]()
��������衿����1:�÷�ӦΪ���ȷ�Ӧ
����2:��Ӧ���ɵ�Mn2���Ը÷�Ӧ�д�����
����3:K���Ը÷�Ӧ�д�����
��С��ͬѧδ���Ũ��ʹ��Ӧ���ʼӿ�ļ��裬ԭ���� ��
����ơ����ʵ�顿��1����ȡ g���ᾧ��(H2C2O4��2H2O)������500 mL 0.10 mol/L H2C2O4��Һ��
�������������б����õ���2�ֶ���������������ƽ�� ��
�����в�����ʹ������ҺŨ��ƫ�͵��� (������ѡ�����ĸ���)��
A����ȡ���ᾧ��ʱ�������ᾧ�����������ƽ���� |
B������ʱ���ӿ̶��� |
C�����ձ�����Һת�Ƶ�����ƿ֮ǰ������ƿ������������ˮ |
D��ҡ�Ⱥ�����ҺҺ����ڿ̶��ߣ������ý�ͷ�ιܼ�ˮ�ٶ��� |
��2�����̽������¼����
ʵ�� | �ձ��������Լ�������(mL) | �������� | ��Һ��ɫʱ��(s) | |||
0.10 mol/L | ��Ũ�� | H2O | 0.50 mol/L | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | ˮԡ�����¶�65 �� | 15 |
3 | 30 | 20 | 30 | 20 | ��������MnSO4���� | 3.6 |
4 | 30 | 20 | x | 20 | ����5 mL 0.10 mol/LK2SO4��Һ | 18 |
��x = ������2����
��3������KMnO4������ˮ���л�������أ�Ϊ���ƺ��ȶ���KMnO4��Һ����Ũ����궨��ȡ10.00 mL 0.10 mol/L H2C2O4��Һ����ƿ�У�����10 mL 0.50 mol/Lϡ���ᣬ�ã�2����KMnO4��Һ�ζ�����ƿ��ǡ�ó�dz��ɫ���Ұ���Ӳ���ɫ����¼���ݣ�ƽ������ʵ�飬ƽ������KMnO4��Һ40.00 mL���������Һ������KMnO4��Һ��Ӧ�����ӷ���ʽΪ�� ������ʵ����KMnO4��Һ�����ʵ���Ũ��Ϊ ��
���𰸡���������衿�淴Ӧ��Ũ�Ƚ��ͣ���Ӧ���ʼ���
����ơ����ʵ�顿��1��6.3 g ��500 mL����ƿ ��A��D ��2��25 mL
��3��5H2C2O4��2MnO4�� ��6H��=10CO2��2Mn2����8H2O 0.010 mol/L
�������������������������衿 ��Ϊ�淴Ӧ��Ũ�Ƚ��ͣ���Ӧ���ʼ�������ʵ���з�Ӧ�����Ǽӿ�ġ�
����ơ����ʵ�顿��1�����ᾧ�������="0.5��0.1��126=6.3" g �� ����ΪҪ����500������Һ������ѡ��500 mL����ƿ�� ��A����ΪҪ����6.3�˲��ᾧ�壬���������̣���ʵ�ʳ���������ƫ�ͣ�Ũ��ƫ�ͣ�B����������Һ�����С��Ũ��ƫ��C������ƿ����ˮ����Ӱ��Ũ�ȣ�D��ҡ�Ⱥ�Ӧ�ü�ˮ������ˮ����Ũ��ƫС������ѡA��D�� ��2����Ϊʵ����Ҫ������Һ��Ũ����ͬ�����Ի����Һ�������Ӧ��ȣ�������Ҫ����ˮ�����Ϊ25 mL����3�����ᱻ������������ɶ�����̼�����ӷ���ʽΪ��5H2C2O4��2MnO4�� ��6H��=10CO2��2Mn2����8H2O��������ص�Ũ��="5:(0.1��10)=2:(" 40��x) ��x="0.010" mol/L


 �߽�������ϵ�д�
�߽�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���10mL0.1mol��![]() ��HA��Һ����ε���0.1mol��
��HA��Һ����ε���0.1mol��![]() ��ROH��Һ��������ҺpH�����������ı仯��ͼ�������ж���ȷ����
��ROH��Һ��������ҺpH�����������ı仯��ͼ�������ж���ȷ����
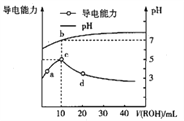
A. ROH����Һ�еĵ��뷽��ʽΪ![]()
B. c����![]() �������
�������![]() Ũ����С
Ũ����С
C. b����ڣ� ![]()
D. �������¶ȣ�a��d����pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�¶��£������Ϊ1L�����������ܱ������з������淴Ӧ��N2��g��+3H2��g��![]() 2NH3��g����H=һ92kJ/mol��ʵ������ʼ��ƽ��ʱ���й��������±���
2NH3��g����H=һ92kJ/mol��ʵ������ʼ��ƽ��ʱ���й��������±���

����������������
A�������١����з�Ӧ��ƽ�ⳣ�����
B��ƽ��ʱ������������NH3�����������Ϊ1/3
C���������д�ƽ��ʱ�ų�������Q��46 kJ
D�������������Ϊ2L����ƽ��ʱ�ų���������46kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������б仯�У���Ҫ������ʵ�����������ʵ�ֵ��ǣ� ��
A.Fe��Fe3+B.CO2��COC.H2O2��O2D.Cl2��ClO-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A.�ƺ�ˮ��ӦNa��H2O��Na����OH����H2��
B.̼�����ϡ���ᷴӦ��2H����CO32-��CO2����H2O
C.��������ˮ�����ӷ���ʽΪCl2+H2O2H++Cl-+ClO-
D.̼��������Һ�м�����HCO3-+CH3COOH��CH3COO-+H2O+CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʣ���Cl2��KCl��NaHCO3��ŨH2SO4��NH3��Al��OH��3������������
��1��ֻ�����Ӽ����ɵ���_______��
��2���д̼�����ζ������ʹ��̪��Һ������_______��
��3�����³�ѹ�³ʻ���ɫ��������_______��
��4��ʵ���ҳ��������������_______��
��5����ǿ���ǿ����Һ���ܷ�����Ӧ����û�������������_______��
��6����ѧ���ʲ��ȶ�����һ���������ֽ������������ʵ���_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������������ȷ���ǣ�
A. 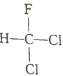 ��
��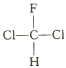 ��Ϊͬ���칹��
��Ϊͬ���칹��
B. 15g������CH3�����еĵ�������9NA
C. 7.8g���к��е�̼̼˫����Ϊ0.3NA
D. ��״���£�2.24 L CCl4�е�ԭ������Ϊ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʳ��Ϊԭ�Ͻ����������ۺ����õ�ijЩ������ͼ��
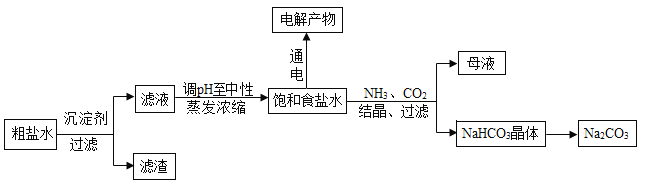
��1�� ��ȥ�����е�������CaSO4ͨ����Na2CO3����������ƽ���ƶ�ԭ������˵��:_____________��
��2�� ����ϰ���ϰѵ�ⱥ��ʳ��ˮ�Ĺ�ҵ�����ȼҵ.ͼ1��ʾ��ⱥ��NaCl ��Һ��װ�ã�X��Y��ʯī����ʵ�鿪ʼ����Y �缫��Ӧ����ķ�����_________________��
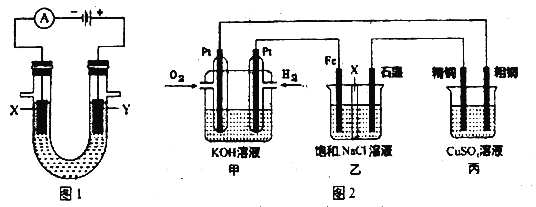
��3�� ��������NaHCO3������ĸҺ�м��������ʯ�ң���ɻ��һ�ֿ���ѭ��ʹ�õ����壬�仯ѧʽ��__________��
��4�� ijͬѧ���һ��ȼ�ϵ������ͼ2��ʾ����Ŀ����̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����X Ϊ�����ӽ���Ĥ������Ҫ��ش��������:
��ͨ�������缫�ķ�ӦʽΪ__________________��
�ڷ�Ӧһ��ʱ�������װ���е����̪��Һ��______________��������������ʯī������������Һ�ȱ�졣
�������ͭ�к���п���������ʣ���װ���з�Ӧһ��ʱ�������ͭ��ҺŨ�Ƚ�___________����������������С����������������
�����ڱ�״������224mL�����μӷ�Ӧ������װ�������缫�����ɵ������ڱ�������Ϊ_________L��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com