
����Ŀ�����������ʣ���Cl2��KCl��NaHCO3��ŨH2SO4��NH3��Al��OH��3������������
��1��ֻ�����Ӽ����ɵ���_______��
��2���д̼�����ζ������ʹ��̪��Һ������_______��
��3�����³�ѹ�³ʻ���ɫ��������_______��
��4��ʵ���ҳ��������������_______��
��5����ǿ���ǿ����Һ���ܷ�����Ӧ����û�������������_______��
��6����ѧ���ʲ��ȶ�����һ���������ֽ������������ʵ���_______��
���𰸡��ڢݢ٢ܢޢ�
��������
��1��ֻ�����Ӽ�����˵���������ɼ������Ӻͼ������ӹ��ɣ���ԭ�����γɵ����ӣ�KCl��ֻ�����ӹ��ɵ����ʣ���Ϊ�ڣ�
��2���̼�����ζ������ʹ��̪��Һ�����Ǽ������壬Ӧ����NH3����Ϊ�ݣ�
��3�������ǻ���ɫ���壬��Ϊ�٣�
��4��Ũ���������ˮ�Կ��Ը������壬��Ϊ�ܣ�
��5����ǿ���ǿ����Һ���ܷ�����Ӧ����û�������������������������������������ǿ���ǿ�Ӧ�ķ���ʽΪAl��OH��3+3H+��Al3++3H2O��Al��OH��3+OH��=AlO2��+2H2O����Ϊ�ޣ�
��6 ����ѧ���ʲ��ȶ�����һ���������ֽ������������ʵ���̼�����ƣ�����ʽΪ2NaHCO3![]() Na2CO3+H2O+CO2���������������ȷֽ�������������ˮ�������ʣ������������Ⱥ��ѷֽ⣬��Ϊ�ۡ�
Na2CO3+H2O+CO2���������������ȷֽ�������������ˮ�������ʣ������������Ⱥ��ѷֽ⣬��Ϊ�ۡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�صĵ��ʺͳ����Ļ������ڹ���ũҵ��������;�㷺��
��1��������ʳƷ�������������_____��������������Ļ�������_____���������ڿ�������HCl�����а���������������Ļ�ѧ��Ӧ����ʽ��_______��
��2����δ����ũҵ���������ʡ�ʵ���ҿ��ù���NH4Cl�����Ca��OH��2���ȷ�Ӧ���Ʊ��������仯ѧ����ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʱ���䴦������������ǣ� ��
A.��CO�ж���ת�Ƶ�ͨ�紦����
B.Ƥ���ϲ���մ��Ũ��Һ�������ô���ˮ��ϴ��Ȼ��Ϳ��2% ��������Һ
C.�����ƾ�ʧ��ʱ��������ʪĨ������
D.ҹ�����������ŵ���Ũ��ú��ζ���������Ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�ϼ�ʽ̼��þ[4MgCO3��Mg(OH)2��4H2O],�ֳ�����̼��þ����������þ������������Ϊ̼��þ90%,̼���10%��̼������ȡ��
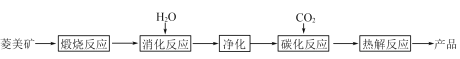
��1���������б�������,ѡ��������Ӧ������¶�__________;������___________________________��
�����¶�/�� | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
ת����/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
��2��̼����Ӧ������Mg(HCO3)2,����Mg(HCO3)2�Ļ�ѧ����ʽΪ____________��
��3������ͼ��__________��__________����Ϊ̼����Ӧ�ṩ������̼Դ��
��4���й����������±ˮ̼������ȡ����̼��þ��
��±ˮ�к���Fe2+��Mn2+,����Ũ��С��1��10-5mol��L-1ʱ,������Ϊ��ȫ��ȥ������ʱ��������ҺPHΪ9.5ʱ,��ʱMn2+С��__________mol��L-1,�������������
���� | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
�������Fe2+ת��ΪFe3+,�ӻ����Ƕ�ѡ������ʵ�������Ϊ__________��
A��Ca(ClO)2 B��Cl2 C��H2O2 D��HNO3
�����з�����,�Ϻõ�Ϊ__________��������______________________��
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(H2C2O4)��Һ������KMnO4��Һ��Ӧʱ����Һ��ɫ����������죬ijѧϰС��̽����Ӧ������ʹ��ɫ�ӿ����Ҫԭ��������:
���������ϡ�KMnO4��Һ����H2C2O4�ķ�Ӧ����Ϊ��
![]()
��������衿����1:�÷�ӦΪ���ȷ�Ӧ
����2:��Ӧ���ɵ�Mn2���Ը÷�Ӧ�д�����
����3:K���Ը÷�Ӧ�д�����
��С��ͬѧδ���Ũ��ʹ��Ӧ���ʼӿ�ļ��裬ԭ���� ��
����ơ����ʵ�顿��1����ȡ g���ᾧ��(H2C2O4��2H2O)������500 mL 0.10 mol/L H2C2O4��Һ��
�������������б����õ���2�ֶ���������������ƽ�� ��
�����в�����ʹ������ҺŨ��ƫ�͵��� (������ѡ�����ĸ���)��
A����ȡ���ᾧ��ʱ�������ᾧ�����������ƽ���� |
B������ʱ���ӿ̶��� |
C�����ձ�����Һת�Ƶ�����ƿ֮ǰ������ƿ������������ˮ |
D��ҡ�Ⱥ�����ҺҺ����ڿ̶��ߣ������ý�ͷ�ιܼ�ˮ�ٶ��� |
��2�����̽������¼����
ʵ�� | �ձ��������Լ�������(mL) | �������� | ��Һ��ɫʱ��(s) | |||
0.10 mol/L | ��Ũ�� | H2O | 0.50 mol/L | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | ˮԡ�����¶�65 �� | 15 |
3 | 30 | 20 | 30 | 20 | ��������MnSO4���� | 3.6 |
4 | 30 | 20 | x | 20 | ����5 mL 0.10 mol/LK2SO4��Һ | 18 |
��x = ������2����
��3������KMnO4������ˮ���л�������أ�Ϊ���ƺ��ȶ���KMnO4��Һ����Ũ����궨��ȡ10.00 mL 0.10 mol/L H2C2O4��Һ����ƿ�У�����10 mL 0.50 mol/Lϡ���ᣬ�ã�2����KMnO4��Һ�ζ�����ƿ��ǡ�ó�dz��ɫ���Ұ���Ӳ���ɫ����¼���ݣ�ƽ������ʵ�飬ƽ������KMnO4��Һ40.00 mL���������Һ������KMnO4��Һ��Ӧ�����ӷ���ʽΪ�� ������ʵ����KMnO4��Һ�����ʵ���Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��һ�ֱ�ɫ�۾��ľ�Ƭ����ͨ����й⽺Ƭ�к���±��������Ƭ�仯���� Ϊ±�����ڹ�������·�����ѧ��Ӧ���䷴Ӧʽ��_______ ������й⽺Ƭ�ع� �Ļ�ѧ��Ӧ��_______��
��2�����ҹ��ɺ����صĻ������������������÷ɻ������ڻ��������ع��������֧���в����⻯����AgI����ɱ���ʵ���˹����꣨���˹���ѩ�����ﵽ���ֵ�Ŀ�ģ������й��˹�����������У�����Ϊ�������ǵ���_______��
A������ũҵ���������ʹ��������ĸ�����һ����Ч��
B����ʹ�õĵ⻯���е��ؽ���Ԫ�ض����������Ⱦ
C����ʹ�õ� AgI �绻�ɸɱ����ɱ����ؽ���Ԫ�ض���������Ⱦ
D�����������սʤ��Ȼ�ı��֣����������������������ģ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2H2��g��+CO��g��![]() CH3OH��g��Ϊ���ȷ�Ӧ���Ը÷�Ӧ������˵����ȷ���ǣ� ��
CH3OH��g��Ϊ���ȷ�Ӧ���Ը÷�Ӧ������˵����ȷ���ǣ� ��
A. ��÷�ӦΪ���ȷ�Ӧ���ʲ����ȾͿɷ���
B. ��ͬ�����£�2 mol H2��������1 mol CO������һ������1 mol CH3OH������
C. ��ͬ�����£���Ӧ��2 mol H2��1 mol CO��������һ������������1 mol CH3OH��������
D. �ﵽƽ��ʱ��CO��Ũ����CH3OH��Ũ��һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ڹ�ũҵ�����о�����Ҫ���á�
��1��ijС����й�ҵ�ϳɰ�N2(g)��3H2(g)![]() 2NH3(g) ��H��0��ģ���о�����1L�ܱ������У��ֱ����0.1mol N2��0.3mol H2��ʵ��������������c��N2����ʱ�䣨t���ı仯��ͼ��ʾ��
2NH3(g) ��H��0��ģ���о�����1L�ܱ������У��ֱ����0.1mol N2��0.3mol H2��ʵ��������������c��N2����ʱ�䣨t���ı仯��ͼ��ʾ��

ʵ�����ӿ�ʼ���ﵽƽ��״̬�Ĺ����У���H2��ʾ��ƽ����Ӧ����Ϊ ����ʵ������ȣ���ʵ���������õ�ʵ����������Ϊ ������ĸ����ʵ���������õ�ʵ����������Ϊ ������ĸ����
a������ѹǿb����Сѹǿc�������¶�d�������¶�e��ʹ�ô���
��2��NH3�����ڴ��������еĵ�������䷴Ӧԭ��Ϊ2NH3(g)��NO(g)��NO2(g)![]() 2N2(g)��3H2O(g) ��H��0����߷����е��������ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ������ĸ��
2N2(g)��3H2O(g) ��H��0����߷����е��������ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ������ĸ��
a�������¶� b������ѹǿ c������NH3��Ũ��
��3��NCl3��ˮ����ˮ�ⷴӦ������NH3��ͬʱ�õ� ���ѧʽ����ClO2�ǹ���Ч���������Ʊ�ԭ��ΪNCl3��6ClO2����3H2O=NH3����6ClO2��3OH����3Cl������ת��1mol���ӣ�����ȡClO2������Ϊ ��
��4��25��ʱ����amol��L-1�İ�ˮ��bmol��L-1����������ϣ���Ӧ����Һǡ�������ԣ���a b����������������������=��������a��b��ʾNH3��H2O�ĵ���ƽ�ⳣ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ұ�ⱻ�ó涣ҧ����ֺ����������ɼ�����HCOOH����ɵ������������̽����
I . HCOOH ����̽��
��1�����������ڶ�Ԫ�����___________��
a��HCOOH b��H2CO3 c��H2C2O4 d��CH3CHOHCH2COOH
��2������ʵ����ʵ��֤������Ϊ�������___________��
a.HCOONH4��Һ������
b.���������![]() ��Һ������������
��Һ������������
C.�����£�0.1mol��L-1�ļ�����Һ��pHԼΪ3
d.��Ũ�ȵ������������Һ��ǰ�ߵĵ���������ǿ
��3������С�մ���Һ�����ó涣ҧ��ɵĺ��ף��������ӷ���ʽ��ʾ��ԭ��_________��
�������Ʊ�����ͭ̽��
���ԭ���ͻ�ѧ����ʽ���£�
��������ͭ��̼�����������Ƶü�ʽ̼��ͭ��Ȼ���ʽ̼��ͭ������ᷴӦ�Ƶ���ˮ����ͭ![]() ���壺
���壺
![]()
![]()
ʵ�鲽�����£�
��4����ʽ̼��ͭ���Ʊ���
![]()
�ٲ������ǽ�һ����![]() �����
�����![]() ����һ��ŵ��в�����ϸ����Ͼ��ȡ�
����һ��ŵ��в�����ϸ����Ͼ��ȡ�
�ڲ��������ڽ����½���������ֶ�λ���������ˮ�У���Ӧ�¶ȿ�����70��-80�����¶Ȳ��ܹ��ߵ�ԭ����________________________________��
�۲��袢�ĺ��������й��ˡ�ϴ�ӵȡ���������Ƿ���ϴ�Ӹɾ��ķ���Ϊ________��
��5������ͭ������Ʊ���
��Cu(OH)2CuCO3��������ձ��У�����һ������������ˮ������μ����������ʽ̼��ͭǡ��ȫ���ܽ⣬���ȹ��˳�ȥ�������������ʡ���ͨ�����������Һ��ԭ���������֮һʱ����ȴ�������壬���ˣ�����������ˮ�Ҵ�ϴ�Ӿ��� 2��3 �Σ����ɣ��õ���Ʒ��
�������ȹ������У���������������ԭ����_________________��
�����Ҵ�ϴ�Ӿ����Ŀ����________________________________��
������ʵ����ȡԭ�� CuSO45H2O ����� NaHCO3 ����������ֱ�Ϊ12.5 g ��9.5 g��ʵ��� �������ճ������õIJ�ƷΪ 7.91 g�������Ϊ________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com