
【题目】水合碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O],又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90%,碳酸钙10%)碳化法制取:
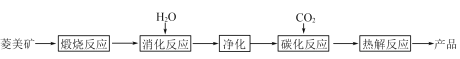
(1)根据下列表格数据,选择消化反应的最佳温度__________;理由是___________________________。
消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为____________。
(3)流程图中__________和__________可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol·L-1时,可以认为完全除去。常温时当调节溶液PH为9.5时,此时Mn2+小于__________mol·L-1,不会沉淀出来。
物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为__________。
A.Ca(ClO)2 B.Cl2 C.H2O2 D.HNO3
③下列方案中,较好的为__________,理由是______________________。
![]()
【答案】 70℃ 温度进一步升高同等幅度,转化率几乎不变。但能耗增加 Mg(OH)2+2CO2=Mg(HCO3)2 煅烧反应 热解反应 10-5 C 方案2 加入碳酸钠的产品中易混入更多杂质,不易提纯
【解析】(1)由图可知,70℃时,物质的转化率较大,但是温度进一步升高同等幅度,转化率几乎不变,但能耗增加;
(2)由流程图可知Mg(HCO3)2由Mg(OH)2和2CO2反应而来,反应为:Mg(OH)2+2CO2═Mg(HCO3)2;
(3)煅烧反应中碳酸镁和碳酸钙生成二氧化碳,热解反应生成二氧化碳;
(4)①已知:Ksp(Mn(OH)2)=10-14,常温时当调节溶液pH为9.5时,c(OH-)=10-4.5,此时Mn2+小于不沉淀,则c(Mn2+)c(OH-)2<Ksp(Mn(OH)2)=10-14,则c(Mn2+)<![]() =10-5;
=10-5;
②把Fe2+转化为Fe3+,从环境角度选择过氧化氢的产物为水,不污染环境,故答案为C;
③利用卤水碳化法制取轻质碳酸镁,方案1中加入碳酸钠的产品中易混入更多杂质,不易提纯,故方案2更合适。


科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g液态甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为: 。
(2)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量。写出1mol N2和O2完全反应的热化学方程式为: 。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/LNaOH 溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是

A. O处溶液中的阳离子为:H+、Fe2+、Fe3+、Al3+
B. DE段反应的离子方程式为:NH4++OH-=NH3·H2O
C. 合金中,n(Al)=0.008mol
D. 欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,1.4gN2和CO的混合气体含有的电子数为0.7NA
B.标况下,足量Fe在2.24L氯气中燃烧,反应中转移电子的数目为0.3NA
C.1L0.1 mol·Lˉ1 醋酸溶液中含有H+离子的数目为0.1NA
D.18gD2O所含有的质子数,电子数均为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组性质比较中,不正确的是( )
A.元素最高化合价:Al>Mg
B.金属性:Al>Mg
C.酸性:H2SO4>H3PO4
D.稳定性:HF>HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图得出的结论正确的是( )
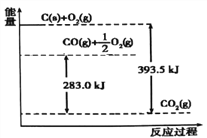
A. 1mol C完全燃烧生成CO2时放出的热量为393.5 kJ/mol
B. 2C(s)+O2(g)=2CO(g) △H=-221.0 kJ/mol
C. 2CO2 (g)=2CO(g)+O2(g) △H=+283.0 kJ/mol
D. C(s)+O2(g)= CO2 (g) △H=+393.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B.一种烃在足量的氧气中燃烧并通过浓H2SO4,减少的体积就是生成的水蒸气的体积
C.某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减少,则y>4;否则y<4
D.相同质量的烃,完全燃烧,消耗O2越多,烃中含氢元素的质量分数就越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反应II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
写出NO分解生成N2与O2的热化学方程式_____。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I ,测得不同时间的NH3和O2,的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述中正确的是_____________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3) =6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均速率v( NO)=0.088 mol·L-1·min-1
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:

①该催化剂在低温时选择反应_______(填“ I ”或“ II”)。
②52℃时,4NH3+3O2![]() 2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
③C点比B点所产生的NO的物质的量少的主要原因________。
(4)制备催化剂时常产生一定的废液,工业上常利用氢硫酸检测和除去废液中的Cu2+。
已知:25℃时,K1(H2S) =1.3×10-7,K1(H2S) =7.1×10-15,Ksp(CuS) =8.5×10-45
①在计算溶液中的离子浓度时,涉及弱酸的电离通常要进行近似处理。则0.lmol L-1氢硫酸的pH≈______(取近似整数)。
②某同学通过近似计算发现0.lmol L-1氢硫酸与0.0lmol L-1氢硫酸中的c(S2-)相等,而且等于_____mol·L-1
③已知,某废液接近于中性,若加入适量的氢硫酸,当废液中c(Cu2+) >_____ mol·L-1(计算结果保留两位有效数字),就会产生CuS沉淀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com