
°Њћвƒњ°њ—–ЊњЈҐѕ÷£ђѕхЋб‘љѕ°£ђїє‘≠≤ъќп÷–µ™‘™ЋЎµƒїѓЇѕЉџ‘љµЌ°£ƒ≥Ќђ—І»° Ѕњµƒћъ¬ЅЇѕљр”л„гЅњЇ№ѕ°µƒѕхЋб≥дЈ÷Јі”¶£ђ√ї”–∆шћеЈ≈≥ц°£‘ЏЈі”¶љб шЇуµƒ»№“Ї÷–£ђ÷рµќЉ”»л4 mol/LNaOH »№“Ї£ђЋщЉ”NaOH»№“Їµƒћеїэ£®mL£©”л≤ъ…ъµƒ≥Ѕµнµƒќп÷ µƒЅњ(mol)µƒєЎѕµ»зЌЉЋщ Њ°£ѕ¬Ѕ–ЋµЈ®≤ї’э»Јµƒ «

A. Oі¶»№“Ї÷–µƒ—фјл„”ќ™£ЇH+°ҐFe2+°ҐFe3+°ҐAl3+
B. DEґќЈі”¶µƒјл„”Јљ≥ћ љќ™£ЇNH4++OH-=NH3°§H2O
C. Їѕљр÷–£ђn(Al)=0.008mol
D. ”ы≤вґ®Fµг≥Ѕµнµƒ÷ Ѕњ£ђ µ—й≤љ÷и «£Їєэ¬Ћ°Ґѕіµ”°ҐЄ…‘п°Ґ≥∆Ѕњ
°Њір∞Є°њA
°Њљвќц°њA£Ѓ”…ЌЉњ…÷™£ђOCґќЈҐ…ъµƒ «ЋбЉо÷–ЇЌ£ђЋµ√чѕхЋбєэЅњ£ђ»№“Ї÷–≤їњ…ƒ№”–Fe2+£ђє Aінќу£їB£ЃDEґќµќЉ”µƒNaOH»№“Ї”л»№“Ї÷–µƒNH4+Јі”¶£ђЈі”¶µƒјл„”Јљ≥ћ љќ™NH4++OH-=NH3°§H2O£ђє B’э»Ј£їC£Ѓ”…ЌЉњ…÷™£ђЊЁEFґќЈҐ…ъAl£®OH£©3+OH-=AlO2-+2H2O£ђ«“DEґќѕыЇƒµƒNaOH»№“Їћеїэќ™2mL£ђњ…÷™n[Al£®OH£©3]=4.0mol/L°Ѕ0.002L=0.008mol£ђЄщЊЁ¬Ѕ‘™ЋЎ ЎЇг£ђє їмЇѕљр ф÷–n£®Al£©=0.008mol£ђє C’э»Ј£їD£Ѓ”ы≤вґ®Fµг≥Ѕµнµƒ÷ Ѕњ£ђ”¶љЂї•≤їѕа»№µƒєћће”л“ЇћеЈ÷јл£ђ≤Ґѕіµ”≥ЅµнЄљ„≈µƒ‘”їѓ£ђ‘ўЄ…‘п≥∆Ѕњ£ђє µ—й≤љ÷и «£Їєэ¬Ћ°Ґѕіµ”°ҐЄ…‘п°Ґ≥∆Ѕњ£ђє D’э»Ј£їір∞Єќ™A°£



| ƒкЉґ | Єя÷–њќ≥ћ | ƒкЉґ | ≥х÷–њќ≥ћ |
| Єя“ї | Єя“ї√вЈ—њќ≥ћЌ∆Љц£° | ≥х“ї | ≥х“ї√вЈ—њќ≥ћЌ∆Љц£° |
| Єяґю | Єяґю√вЈ—њќ≥ћЌ∆Љц£° | ≥хґю | ≥хґю√вЈ—њќ≥ћЌ∆Љц£° |
| Єя»э | Єя»э√вЈ—њќ≥ћЌ∆Љц£° | ≥х»э | ≥х»э√вЈ—њќ≥ћЌ∆Љц£° |
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њѕ¬Ѕ–Єч„靥Ѕ£÷–,‘Џ“їґ®ћхЉюѕ¬Њщњ…“‘„ч—хїѓЉЅµƒ «
A. F-°ҐBr-°ҐS2- B. Fe3+°ҐMnO4£≠°ҐNO3£≠
C. Cl2°ҐHClO°ҐMg D. ClO-°ҐCl-°ҐAg+
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њµ™їѓ¬Ѕ(AlN) «“ї÷÷–¬–ЌќёїъЈ«љр ф≤ƒЅѕ°£ќ™ЅЋЈ÷ќцƒ≥AlN—щ∆Ј£®—щ∆Ј÷–µƒ‘”÷ ≤ї”лNaOH»№“ЇЈі”¶£©÷– AlNµƒЇђЅњ£ђƒ≥ µ—й–°„й…иЉ∆ЅЋ»зѕ¬Ѕљ÷÷ µ—йЈљ∞Є°£“—÷™£ЇAlN+NaOH+H2O£љNaAlO2+NH3°ь
°ЊЈљ∞Є1°њ»°“їґ®Ѕњµƒ—щ∆Ј£ђ”√“‘ѕ¬„∞÷√≤вґ®—щ∆Ј÷–AlNµƒіњґ»(Љ–≥÷„∞÷√“—¬‘»•)°£
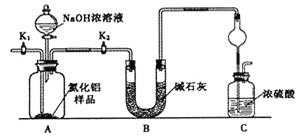
£®1£©…ѕЌЉ„∞÷√÷–£ђU–ќє№B÷–Ћщ„∞єћћеќ™________£ђC÷–«т–ќЄ…‘пє№µƒ„ч”√ «_______________________°£
£®2£©єЎ±’K1ітњ™K2£ђ‘ўітњ™Ј÷“Ї¬©ґЈїо»ы£ђЉ”»лNaOH≈®»№“Ї£ђ÷Ѕ≤ї‘ў≤ъ…ъ∆шће°£ітњ™K1£ђЌ®»лµ™∆ш“їґќ ±Љд£ђ≤вґ®C„∞÷√Јі”¶«∞Їуµƒ÷ Ѕњ±дїѓ°£Ќ®»лµ™∆шµƒƒњµƒ «_______________________________________°£
£®3£©”…”Џ…ѕ ц„∞÷√їєіж‘Џ____________»±ѕЁ£ђµЉ÷¬≤вґ®љбєы∆ЂЄя°£
°ЊЈљ∞Є2°њ∞і“‘ѕ¬≤љ÷и≤вґ®—щ∆Ј÷–AlNµƒіњґ»£Ї
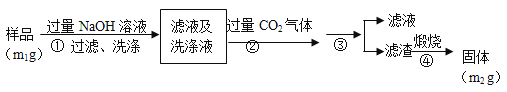
£®4£©≤љ÷襏…ъ≥…≥Ѕµнµƒјл„”Јљ≥ћ љќ™___________________°£
£®5£©≤љ÷襟µƒ≤ў„ч÷–”√µљµƒ÷ч“™≤£ЅІ“«∆ч «_________°£AlNµƒіњґ» «__________£®”√m1°Ґm2±н Њ£©°£
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њѕ¬Ѕ–»»їѓ—ІЈљ≥ћ љ й–і’э»Јµƒ «£® £©
A£Ѓ2SO2+O2![]() 2SO3 °чH=-196.6kJ/mol
2SO3 °чH=-196.6kJ/mol
B£ЃC(s)+O2(g)£љCO2(g) °чH=+393.5kJ/mol
C£Ѓ‘Џ500°ж°Ґ30MPaѕ¬£ђљЂ0.5molN2ЇЌ1.5molH2÷√”Џ√№±’»Ё∆ч÷–≥дЈ÷Јі”¶…ъ≥…NH3(g)£ђЈ≈≥ц»»Ѕњ19.3kJ£ђ∆д»»їѓ—ІЈљ≥ћ љќ™£ЇN2(g)+3H2(g)![]() 2NH3(g) °чH=-38.6kJ/mol
2NH3(g) °чH=-38.6kJ/mol
D£Ѓ2.00gC2H2∆шћеЌк»Ђ»Љ…’…ъ≥…“ЇћђЋЃЇЌґю—хїѓћЉ∆шће£ђЈ≈≥ц99.6kJµƒ»»Ѕњ£ђЄ√Јі”¶µƒ»»їѓ—ІЈљ≥ћ љќ™£Ї2C2H2(g)+5O2(g)£љ4CO2(g)+2H2O(l) °чH=-2589.6kJ/moL
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њѕт100mLNaOH»№“Ї÷–Ќ®»л“їґ®ЅњµƒCO2∆шће£ђ≥дЈ÷Јі”¶Їу£ђ‘ўѕтЋщµ√»№“Ї÷–÷рµќЉ”»л2.0mol/Lµƒ—ќЋб£ђ≤ъ…ъCO2µƒћеїэ”лЋщЉ”—ќЋбћеїэ÷ЃЉдєЎѕµ»зЌЉЋщ Њ°£їЎірѕ¬Ѕ–ќ ћв£Ї
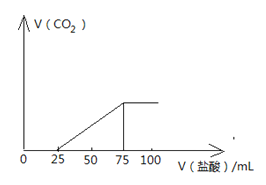
£®1£©‘≠NaOH»№“Їµƒќп÷ µƒЅњ≈®ґ»ќ™ £ї
£®2£©ћв÷–Ќ®»лCO2ЇуЋщµ√»№“Їµƒ»№÷ ≥…Ј÷ќ™ £ђ
»фљЂЋщµ√»№÷ ‘ЏµЌќ¬µЌ—єћхЉюѕ¬’фЄ…£ђЋщµ√єћћеќп÷ £®≤їішљбЊІЋЃ£©µƒ÷ Ѕњќ™ g
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њјы”√”“ЌЉЋщ Њ„∞÷√љш––ѕ¬Ѕ– µ—й£ђ∆д÷–±ы÷– µ—йѕ÷ѕу√и ц’э»Јµƒ «
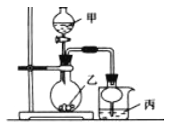
µ—й | ‘ЉЅЉ„ | ‘ЉЅ““ | ‘ЉЅ±ы | ±ы÷–µƒѕ÷ѕу |
A | 70%ЅтЋб | Na2SO3 | „ѕ…Ђ ѓ»п ‘“Ї | »№“Їѕ»±дЇмЇуЌ …Ђ |
B | ≈®—ќЋб | KMnO4 | ЇђЈ”ћ™µƒNaOH»№“Ї | »№“ЇЌ …Ђ |
C | ѕ°—ќЋб | CaCO3 | BaCI2»№“Ї | ”–∞„…Ђ≥Ѕµн…ъ≥… |
D | ≈®∞±ЋЃ | CaO | AlCl3 | ѕ»…ъ≥…∞„…Ђ≥Ѕµн»їЇу≥Ѕµн»№љв |
A. A B. B C. C D. D
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њ2013ƒк јљзїЈЊ≥»’µƒ÷чћвќ™£ЇThink.Eat.Save. °™°™ЋЉ«∞°Ґ ≥Їу°Ґјч––љЏ‘Љ°£∞Ѓї§їЈЊ≥£ђЇ«ї§µЎ«т «ќ“√«√њ“їЄц»Ћ≤їњ…Ќ∆–ґµƒ‘р»ќ°£ѕ¬Ѕ–ѕ÷ѕу”лќџ»Њ‘іґ‘”¶≤ї’э»Јµƒ «
A. Ћб”к°™°™Ѕтµƒ—хїѓќп°Ґµ™µƒ—хїѓќп B. євїѓ—І—ћќн°™°™µ™µƒ—хїѓќп
C. ≥ф—хњ’ґі°™°™Јъ¬»ћю£®ЉіЈъјы∞Ї£© D. ќ¬ “–І”¶°™°™SO2
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њЋЃЇѕЉо љћЉЋб√Њ[4MgCO3°§Mg(OH)2°§4H2O],”÷≥∆«б÷ ћЉЋб√Њ°£≥£јы”√Ѕв√Њњу£®÷ ЅњЇђЅњќ™ћЉЋб√Њ90%,ћЉЋбЄ∆10%£©ћЉїѓЈ®÷∆»°£Ї
£®1£©ЄщЊЁѕ¬Ѕ–±нЄс эЊЁ,—°‘сѕыїѓЈі”¶µƒ„оЉ—ќ¬ґ»__________;јн”… «___________________________°£
ѕыїѓќ¬ґ»/°ж | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
„™їѓ¬ /% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
£®2£©ћЉїѓЈі”¶њ……ъ≥…Mg(HCO3)2,…ъ≥…Mg(HCO3)2µƒїѓ—ІЈљ≥ћ љќ™____________°£
£®3£©Ѕч≥ћЌЉ÷–__________ЇЌ__________њ…“‘ќ™ћЉїѓЈі”¶ћбє©ґю—хїѓћЉ‘і°£
£®4£©”–є§“’…иЉ∆јы”√¬±ЋЃћЉїѓЈ®÷∆»°«б÷ ћЉЋб√Њ£Ї
Ґў¬±ЋЃ÷–Їђ”–Fe2+ЇЌMn2+,µ±∆д≈®ґ»–°”Џ1°Ѕ10-5mol°§L-1 ±,њ…“‘»ѕќ™Ќк»Ђ≥э»•°£≥£ќ¬ ±µ±µчљЏ»№“ЇPHќ™9.5 ±,іЋ ±Mn2+–°”Џ__________mol°§L-1,≤їїб≥Ѕµн≥цјі°£
ќп÷ | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
ҐЏ»зєы∞—Fe2+„™їѓќ™Fe3+,і”їЈЊ≥љ«ґ»—°‘с„оЇѕ µƒ—хїѓЉЅќ™__________°£
A£ЃCa(ClO)2 B£ЃCl2 C£ЃH2O2 D£ЃHNO3
Ґџѕ¬Ѕ–Јљ∞Є÷–,љѕЇ√µƒќ™__________£ђјн”… «______________________°£
![]()
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њ—–ЊњћЉ°Ґµ™Љ∞∆дїѓЇѕќпµƒ„™їѓґ‘”ЏїЈЊ≥µƒЄƒ…∆”–÷Ўіу“в“е°£
£®1£©—хїѓїє‘≠Ј®ѕы≥эNOxµƒ„™їѓ»зѕ¬£Ї![]()
“—÷™£ЇNO(g)+O3(g)=NO2(g)+O2(g) °чH=-200.9kJ/mol
2NO(g)£ЂO2(g)=2NO(g) °чH=-116.2kJ/mol
‘тЈі”¶Iµƒ»»їѓ—ІЈљ≥ћ љќ™________________°£
£®2£©”–»Ћ…иѕлљЂCO∞іѕ¬Ѕ–Јі”¶≥э»•£Ї2CO(g)=2C(s)+O2(g) °чH>0£ђ«лƒгЈ÷ќцЄ√…иѕлƒ№Јс µѕ÷£њ______£®ћо°∞ «°±їт°∞Јс°±) £ђ“јЊЁ «_____________°£
£®3£©“їґ®ћхЉюѕ¬£ђCOњ…”лЈџƒ©„іµƒ«в—хїѓƒ∆„ч”√…ъ≥…Љ„Ћбƒ∆°£“—÷™≥£ќ¬ ±£ђЉ„Ћбµƒµзјл∆љЇв≥£ эKa=1.70°Ѕ10-4°£
Ґў Љ„Ћбƒ∆µƒЋЃ»№“Ї≥ Љо–‘£ђ«л”√јл„”Јі”¶Јљ≥ћ љ±н Њ∆д‘≠“т___________°£
ҐЏ ѕт20mL 0.1mol/LµƒЉ„Ћбƒ∆»№“Ї÷–µќЉ”10ml 0.1mol/Lµƒ—ќЋб£ђїмЇѕ“Ї≥ ______–‘£®ћо°∞Ћб°±їт°∞Љо°±£©£ђ»№“Ї÷–јл„”≈®ґ»і”іуµљ–°µƒЋ≥–тќ™______________°£
£®4£©їо–‘ћњ“≤њ…”√”Џі¶јн∆ы≥µќ≤∆ш÷–µƒNO°£‘Џ2LЇг»Ё√№±’»Ё∆ч÷–Љ”»л0.1000molNOЇЌ2.030molєћћеїо–‘ћњ£ђ…ъ≥…A°ҐBЅљ÷÷∆шће£ђ‘Џ≤їЌђќ¬ґ»ѕ¬≤вµ√∆љЇвћеѕµ÷–Єчќп÷ µƒќп÷ µƒЅњ»зѕ¬±н£Ї
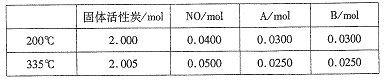
ҐўЄ√Јі”¶µƒ’эЈі”¶ќ™________(ћо°±ќь»»°±їт°∞Ј≈»»°±)Јі”¶°£
ҐЏ 200°ж ±£ђ∆љЇвЇуѕтЇг»Ё»Ё∆ч÷–‘ў≥д»л0.1molNO£ђ‘ўіќ∆љЇвЇу£ђNOµƒ∞ўЈ÷ЇђЅњљЂ_____°££®ћо°∞‘ціу°±°Ґ°∞Љх–°°±їт°∞≤ї±д°±£©°£
ҐџЉ∆ЋгЈі”¶ћеѕµ‘Џ335°ж ±µƒ∆љЇв≥£ э_______°£
≤йњіір∞ЄЇЌљвќц>>
єъЉ —І–£”≈—° - ЅЈѕ∞≤бЅ–±н - ‘ћвЅ–±н
Їю±± °ї•Ѕ™Ќшќ•Ј®ЇЌ≤їЅЉ–≈ѕҐЊў±®∆љћ® | Ќш…ѕ”–Ї¶–≈ѕҐЊў±®„®«ш | µз–≈’©∆≠Њў±®„®«ш | …жјъ Ј–йќё÷ч“е”–Ї¶–≈ѕҐЊў±®„®«ш | …ж∆у«÷»®Њў±®„®«ш
ќ•Ј®ЇЌ≤їЅЉ–≈ѕҐЊў±®µзї∞£Ї027-86699610 Њў±®” ѕд£Ї58377363@163.com