
����Ŀ���о�̼�������仯�����ת�����ڻ����ĸ������ش����塣
��1��������ԭ������NOx��ת�����£�![]()
��֪��NO(g)+O3(g)=NO2(g)+O2(g) ��H=-200.9kJ/mol
2NO(g)��O2(g)=2NO(g) ��H=-116.2kJ/mol
��ӦI���Ȼ�ѧ����ʽΪ________________��
��2���������뽫CO�����з�Ӧ��ȥ��2CO(g)=2C(s)+O2(g) ��H>0����������������ܷ�ʵ�֣�______����ǡ���) ��������_____________��
��3��һ�������£�CO�����ĩ״�����������������ɼ����ơ���֪����ʱ������ĵ���ƽ�ⳣ��Ka=1.70��10-4��
�� �����Ƶ�ˮ��Һ�ʼ��ԣ��������ӷ�Ӧ����ʽ��ʾ��ԭ��___________��
�� ��20mL 0.1mol/L�ļ�������Һ�еμ�10ml 0.1mol/L�����ᣬ���Һ��______�ԣ���ᡱ�������Һ������Ũ�ȴӴ�С��˳��Ϊ______________��
��4������̿Ҳ�����ڴ�������β���е�NO����2L�����ܱ������м���0.1000molNO��2.030mol�������̿������A��B�������壬�ڲ�ͬ�¶��²��ƽ����ϵ�и����ʵ����ʵ������±���
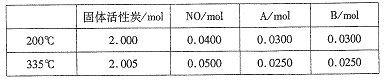
�ٸ÷�Ӧ������ӦΪ________(����ȡ����ȡ�)��Ӧ��
�� 200��ʱ��ƽ���������������ٳ���0.1molNO���ٴ�ƽ���NO�İٷֺ�����_____�������������С�����䡱����
�ۼ��㷴Ӧ��ϵ��335�� ʱ��ƽ�ⳣ��_______��
���𰸡� 3NO(g)+O3(g)===3NO2(g) ��H=��317.1 kJ��mol-1 �� �÷�Ӧ���������ؼ��ķ�Ӧ,����G=��H -T����S,G>0 HCOO����H2O![]() HCOOH + OH�� �� c (Na+)>c(HCOO��)>c (Cl��)>c(H+)>c(OH-) ���� ���� 0.25
HCOOH + OH�� �� c (Na+)>c(HCOO��)>c (Cl��)>c(H+)>c(OH-) ���� ���� 0.25
��������(1)��Ӧ��NO(g)��O3(g)���ݸ�˹���ɣ���NO(g)+O3(g)�TNO2(g)+O2(g)��H=-200.9kJ/mol����2NO(g)+O2(g)�T2NO(g)��H=-116.2kJ/mol����Ŀ�귴Ӧ�ķ�Ӧ�ȵ�����+��������I���Ȼ�ѧ����ʽΪ3NO(g)+O3(g)�T3NO2(g)��H=-317.1kJmol-1��
(2)������G=��H-T��S�жϷ�Ӧ�ܷ��Է����У������G��0����Ӧ���Է����У���G��0����Ӧ�����Է����У�2CO(g)=2C(s)+O2(g)���÷�Ӧ���������ؼ��ķ�Ӧ������G=��H-T��S��G��0������ʵ�֣�
(3)����������ǿ�������Σ�ˮ��ʼ��ԣ�����ˮ��Һ�ʼ��ԣ����ӷ�Ӧ����ʽ��ʾ��ԭ��HCOO-+H2O![]() HCOOH+OH-��
HCOOH+OH-��
����20mL0.1mol/L�ļ�������Һ�еμ�10ml0.1mol/L�����ᣬ�õ������ʵ���Ũ�ȵļ��ᡢ�����ƺ��Ȼ��ƵĻ��Һ���Լ���ĵ���Ϊ������Һ�����ԣ���Һ������Ũ�ȴӴ�С��˳��Ϊc(Na+)��c(HCOO-)��c(Cl-)��c(H+)��c(OH-)��
(4)���¶�����ƽ�������ƶ�����������Ӧ�Ƿ��ȷ�Ӧ��
����200��ʱ�������ʵ�����ϵ��֪����Ӧ����ʽΪ��2NOA+B����������ļ�������ȣ���ƽ���������������ٳ���0.1molNO���൱������ѹǿ��ƽ�ⲻ�ƶ�������NO�İٷֺ��������䣻
��ƽ�ⳣ������ƽ��ʱ�������Ũ����֮�����Ϸ�Ӧ��Ũ����֮��������K= =0.25��
=0.25��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о����֣�����Խϡ����ԭ�����е�Ԫ�صĻ��ϼ�Խ�͡�ijͬѧȡ�����������Ͻ���������ϡ�������ַ�Ӧ��û������ų����ڷ�Ӧ���������Һ�У���μ���4 mol/LNaOH ��Һ������NaOH��Һ�������mL��������ij��������ʵ���(mol)�Ĺ�ϵ��ͼ��ʾ������˵������ȷ����

A. O����Һ�е�������Ϊ��H+��Fe2+��Fe3+��Al3+
B. DE�η�Ӧ�����ӷ���ʽΪ��NH4++OH-=NH3��H2O
C. �Ͻ��У�n(Al)=0.008mol
D. ���ⶨF�������������ʵ�鲽���ǣ����ˡ�ϴ�ӡ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������仯ʾ��ͼ�ó��Ľ�����ȷ����( )
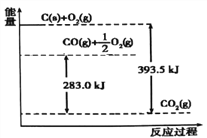
A. 1mol C��ȫȼ������CO2ʱ�ų�������Ϊ393.5 kJ/mol
B. 2C(s)+O2(g)=2CO(g) ��H=-221.0 kJ/mol
C. 2CO2 (g)=2CO(g)+O2(g) ��H=+283.0 kJ/mol
D. C(s)+O2(g)= CO2 (g) ��H=+393.5 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A��ij�л���ȼ��ֻ����CO2��H2O���Ҷ������ʵ�����ȣ������л�������ΪCnH2n
B��һ������������������ȼ�ղ�ͨ��ŨH2SO4�����ٵ�����������ɵ�ˮ���������
C��ij��̬��CxHy������O2ǡ����ȫ��Ӧ�������Ӧǰ�������������(�¶ȣ�100��)����y��4����������٣���y��4������y��4
D����ͬ������������ȫȼ�գ�����O2Խ�࣬���к���Ԫ�ص�����������Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F���ֶ���������Ԫ�أ�ԭ������������������B�ĵ����ڳ�����Ϊ˫ԭ�ӷ��ӣ�����A�ĵ��ʿ��γɷ���X��X��ˮ��Һ�ʼ��ԣ�D�ļ���������X������ͬ����������D��ͬ�����м����Ӱ뾶��С��Ԫ�أ�EԪ�ص�ԭ�������ȴ�������������ӣ�C��F����Ԫ�ص�ԭ������㹲��13�����ӡ���
(1)A��Ԫ�ط���______________��D��Ԫ������ ____________��
(2)C�����ڱ��е�λ��Ϊ��______����______�壬E�����ӽṹʾ��ͼ________��
(3)B��C��E�ֱ���A�γɵĻ����������ȶ�����________(д��ѧʽ)��E��F������������Ӧ��ˮ��������Խ�ǿ����________(д��ѧʽ)
(4)F�ĵ����ڷ�Ӧ�г������������õ��ʵ�ˮ��Һ��E�ĵͼ������ﷴӦ�����ӷ���ʽΪ________________��
(5)X�ڴ�����C�����п�������ȼ�գ�����B�ĵ��ʡ��÷�Ӧ�Ļ�ѧ����ʽΪ��__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Q��Ԫ�����ڱ��е����λ����ͼ��ʾ������˵����ȷ���ǣ� ��

A. Ԫ��X��Ԫ��Z����������ϼ�֮�͵���ֵ����8
B. ԭ�Ӱ뾶�Ĵ�С˳��Ϊ��rX>rY>rZ>rW>rQ
C. ����Y2����Z3���ĺ���������͵��Ӳ���������ͬ
D. Ԫ��W������������Ӧ��ˮ��������Ա�Q��ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ⱥ����ܱ�������ͨ��SO2��NO2��һ��������ʹ��ӦSO2(g)��NO2(g) ![]() SO3(g)��NO(g)�ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ������ʾ����ͼ�ɵó�����ȷ�����ǣ� ��
SO3(g)��NO(g)�ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ������ʾ����ͼ�ɵó�����ȷ�����ǣ� ��
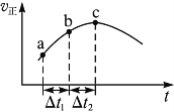
A����Ӧ��c��ﵽƽ��״̬
B����Ӧ��Ũ�ȣ�a��С��b��
C����Ӧ��������������������������
D����t1����t2ʱ��SO2��ת���ʣ�a��b��С��b��c��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3��Ϊһ����Ҫ����ԭ�ϣ�������Ӧ���ڹ�ҵ�����������й����ʷ�Ӧ�Ĵ����о������������863�ƻ���
(1)���������н�ǿ��ѡ���ԣ���רһ�ԡ���֪��
��ӦI��4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) ��H= -905.0 kJ��mol-1
4NO(g) +6H2O(g) ��H= -905.0 kJ��mol-1
��ӦII:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) ��H= -1266.6 kJ��mol-1
2N2(g) +6H2O(g) ��H= -1266.6 kJ��mol-1
д��NO�ֽ�����N2��O2���Ȼ�ѧ����ʽ_____��
(2)�ں��º���װ���г���һ������NH3��O2,��ij�����������½��з�ӦI ,��ò�ͬʱ���NH3��O2,��Ũ�����±���
ʱ��(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol��L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
�������й���������ȷ����_____________��
A.ʹ�ô���ʱ���ɽ��÷�Ӧ�Ļ�ܣ��ӿ��䷴Ӧ����
B.�����������4v��(NH3) =6v��(H2O)ʱ��˵����Ӧ�Ѵ�ƽ��
C.��������![]() =1ʱ��˵����Ӧ�Ѵ�ƽ��
=1ʱ��˵����Ӧ�Ѵ�ƽ��
D.ǰ10�����ڵ�ƽ������v( NO)=0.088 mol��L-1��min-1
(3)��������ʱ�ᷢ����������������ӦI��II��Ϊ����ij�����Ը÷�Ӧ��ѡ���ԣ���1L�ܱ������г���1 mol NH3��2mol O2������й����ʵ�����ϵ����ͼ��

�ٸô����ڵ���ʱѡ��Ӧ_______(� I ���� II������
��52��ʱ��4NH3+3O2![]() 2N2+6H2O��ƽ�ⳣ��K=_______(��Ҫ��ó���������ֻ���г����ּ���ʽ����
2N2+6H2O��ƽ�ⳣ��K=_______(��Ҫ��ó���������ֻ���г����ּ���ʽ����
��C���B����������NO�����ʵ����ٵ���Ҫԭ��________��
(4)�Ʊ�����ʱ������һ���ķ�Һ����ҵ�ϳ�������������ͳ�ȥ��Һ�е�Cu2+��
��֪��25��ʱ��K1(H2S) =1.3��10-7��K1(H2S) =7.1��10-15��Ksp(CuS) =8.5��10-45
���ڼ�����Һ�е�����Ũ��ʱ���漰����ĵ���ͨ��Ҫ���н��ƴ�������0.lmol L-1�������pH��______(ȡ������������
��ijͬѧͨ�����Ƽ��㷢��0.lmol L-1��������0.0lmol L-1�������е�c(S2-)��ȣ����ҵ���_____mol��L-1
����֪��ij��Һ�ӽ������ԣ������������������ᣬ����Һ��c(Cu2+) >_____ mol��L-1(������������λ��Ч���֣����ͻ����CuS������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NiSO46H2O��һ����ɫ������ˮ�ľ��壬�㷺���ڻ�ѧ������������صȣ����ɵ�Ʒ������������⣬�����У�Cu��Zn��Fe��Cr�����ʣ�Ϊԭ�ϻ�á�������������ͼ��
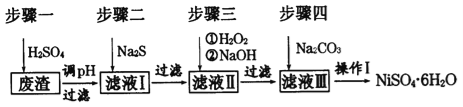
��ش��������⣺
��1����ϡ�����ܽ����ʱ��Ϊ����߽�ȡ���ʿɲ�ȡ�Ĵ�ʩ��_____________(��дһ��)��
��2������Һ�е���������Na2S��Һ��Ŀ���dz�ȥCu2+��Zn2+��д����ȥCu2+�����ӷ���ʽ:_______________��
��3��������������Һ�����Ҫ�ɷ���___________��
��4��ȷ����������Na2CO3��Һ������̼��������ȫ�����ļ�ʵ�鷽����______________��
��5������I��ʵ�鲽������Ϊ(ʵ���п�ѡ�õ��Լ�����Һ������ˮ��pH��ֽ)��
��_______________��
��_______________��
������Ũ������ȴ�ᾧ�����˵�NiSO4��6H2O����
�� �������Ҵ�ϴ��NiSO4��6H2O���岢����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com