
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C. 离子Y2-和Z3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,其中丙中实验现象描述正确的是
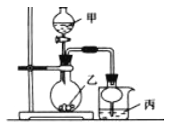
实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
A | 70%硫酸 | Na2SO3 | 紫色石蕊试液 | 溶液先变红后褪色 |
B | 浓盐酸 | KMnO4 | 含酚酞的NaOH溶液 | 溶液褪色 |
C | 稀盐酸 | CaCO3 | BaCI2溶液 | 有白色沉淀生成 |
D | 浓氨水 | CaO | AlCl3 | 先生成白色沉淀然后沉淀溶解 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究NH3的溶解性,某兴趣小组按如图所示装置进行实验
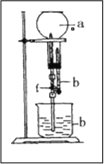
(f为止水夹)
请回答下列问题:
(1)写出实验室制取氨气的化学方程式 ___________________。
(2)要得到干燥的氨气可选用______ 作干燥剂。
A、浓硝酸 B、浓硫酸
C、碱石灰(CaO和NaOH的混合物) D、氢氧化钠溶液
(3)用如图装置进行喷泉实验,烧瓶中已装满干燥氨气,引发水上喷的操作是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,影响一定质量气体体积大小的决定因素是( )
A.气体的密度 B.气体分子体积的大小
C.气体分子间的平均距离 D.气体的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:![]()
已知:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ/mol
2NO(g)+O2(g)=2NO(g) △H=-116.2kJ/mol
则反应I的热化学方程式为________________。
(2)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) △H>0,请你分析该设想能否实现?______(填“是”或“否”) ,依据是_____________。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。已知常温时,甲酸的电离平衡常数Ka=1.70×10-4。
① 甲酸钠的水溶液呈碱性,请用离子反应方程式表示其原因___________。
② 向20mL 0.1mol/L的甲酸钠溶液中滴加10ml 0.1mol/L的盐酸,混合液呈______性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为______________。
(4)活性炭也可用于处理汽车尾气中的NO。在2L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:
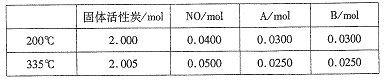
①该反应的正反应为________(填”吸热”或“放热”)反应。
② 200℃时,平衡后向恒容容器中再充入0.1molNO,再次平衡后,NO的百分含量将_____。(填“增大”、“减小”或“不变”)。
③计算反应体系在335℃ 时的平衡常数_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种血小板聚集抑制剂,该药物以2-氯苯甲醛为原料的合成路线如下:
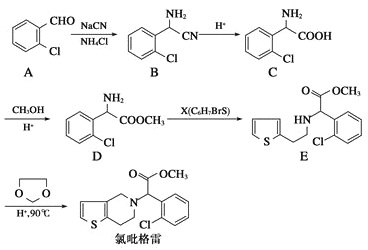
请根据以上信息,结合自己的掌握知识和具有的经验回答下列问题:
(1)分子C中除氯原子外的官能团名称为_________。
(2)X的结构简式为____________。
(3)D→E的反应类型是__________反应。
(4)分子C在一定条件下生成一种含有3个六元环的产物的化学方程式_________________
(5)同时满足下列两个条件的B的同分异构体共有____种(不包括B)
①与B含有相同的官能团 ②苯环上的取代基不超过2个。
(6)已知: ![]() 则由乙醇、甲醇为有机原料制备化合物
则由乙醇、甲醇为有机原料制备化合物![]() ,构成需要经历的反应类型有_______ (填写编号)。
,构成需要经历的反应类型有_______ (填写编号)。
①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物![]() 的最后一步反应________________
的最后一步反应________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是

A.液滴中的Cl― 由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-![]() 4OH-
4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-![]() Cu2+
Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10 mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则 ![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1×105 Pa和298 K时,将1 mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
共价键 | H-H键 | N三N键 | N-H键 |
键能(kJ·mol-1) | 436 | 945 | 391 |
工业合成氨的化学方程式:N2+3H2![]() 2NH3,
2NH3,
断开1 mol N2中的化学键需_____ (填“吸收”或“放出”)945 kJ能量,形成2 mol NH3中的化学键需_____ (填“吸收”或“放出”) ________ kJ能量;
在298 K时,取1 mol N2和3 mol H2放入一密闭容器中,在催化剂存在下进行反应。理论上放出或吸收的热量为Q1,则Q1为____________ kJ。
根据上表中的数据判断工业合成氨的反应是______(填“吸热”或“放热”)反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com