
����Ŀ����NaCl��Һ����һ�����������������ϣ�һ��ʱ�����Һ�θ��ǵ�Բ��������(a)�ѱ���ʴ���䰵����Һ�������γ���ɫ���(b)����ͼ��ʾ�����¸��������Ҫԭ����Һ��֮�����������ȱ�Ե�١�����˵����ȷ����

A��Һ���е�Cl�D ��a����b��Ǩ��
B��Һ�α�Ե���������������ĵ缫��ӦΪ��O2��2H2O��4e��![]() 4OH��
4OH��
C��Һ���µ�Fe������ԭ��Ӧ������ʴ�����ɵ�Fe2����a����b��Ǩ�ƣ���b����OH�D�γ�Fe(OH)2����һ����������ˮ�γ�����
D��������Ƕ��һͭ��˿�������壬��ͭ���Ӵ����μ�NaCl��Һ���������ĵ缫��ӦΪ��Cu��2e��![]() Cu2��
Cu2��
���𰸡�B
��������
���������A��������ԭ����У����������������������������Ĺ��ɣ�������Cl-Ӧ��b����a��Ǩ�ƣ�����B��O2��Һ�����ط�Ӧ�������缫��ӦΪ��O2+2H2O+4e-=4OH- ��������ԭ��Ӧ����ȷ��C��Һ���µ�Fe����������Ӧ������ʴ������D��������Ƕ��һͭ��˿�������壬��ͭ���Ӵ����μ�NaCl��Һ������Fe�Ľ�����Ա�ͭǿ��Fe��Ϊ���������������ĵ缫��ӦΪ��Fe-2 e-=Fe2+ ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ����
A�����³�ѹ�£�1.4gN2��CO�Ļ�����庬�еĵ�����Ϊ0.7NA
B������£�����Fe��2.24L������ȼ�գ���Ӧ��ת�Ƶ��ӵ���ĿΪ0.3NA
C��1L0.1 mol��L��1 ������Һ�к���H+���ӵ���ĿΪ0.1NA
D��18gD2O�����е�����������������Ϊ10NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A��ij�л���ȼ��ֻ����CO2��H2O���Ҷ������ʵ�����ȣ������л�������ΪCnH2n
B��һ������������������ȼ�ղ�ͨ��ŨH2SO4�����ٵ�����������ɵ�ˮ���������
C��ij��̬��CxHy������O2ǡ����ȫ��Ӧ�������Ӧǰ�������������(�¶ȣ�100��)����y��4����������٣���y��4������y��4
D����ͬ������������ȫȼ�գ�����O2Խ�࣬���к���Ԫ�ص�����������Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Q��Ԫ�����ڱ��е����λ����ͼ��ʾ������˵����ȷ���ǣ� ��

A. Ԫ��X��Ԫ��Z����������ϼ�֮�͵���ֵ����8
B. ԭ�Ӱ뾶�Ĵ�С˳��Ϊ��rX>rY>rZ>rW>rQ
C. ����Y2����Z3���ĺ���������͵��Ӳ���������ͬ
D. Ԫ��W������������Ӧ��ˮ��������Ա�Q��ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ⱥ����ܱ�������ͨ��SO2��NO2��һ��������ʹ��ӦSO2(g)��NO2(g) ![]() SO3(g)��NO(g)�ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ������ʾ����ͼ�ɵó�����ȷ�����ǣ� ��
SO3(g)��NO(g)�ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ������ʾ����ͼ�ɵó�����ȷ�����ǣ� ��
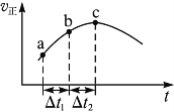
A����Ӧ��c��ﵽƽ��״̬
B����Ӧ��Ũ�ȣ�a��С��b��
C����Ӧ��������������������������
D����t1����t2ʱ��SO2��ת���ʣ�a��b��С��b��c��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ������̽���۱�������Ҫ�Ļ�ѧѧ����������FeCl3��ҺΪʵ���о�����̽�������������֮��ĸ��Ӷ����ԡ�ʵ�����£�
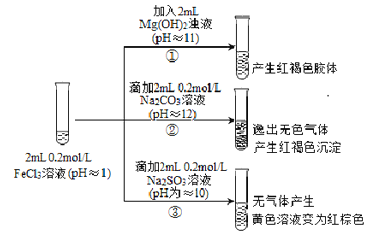
��1�����з�Ӧ�����ӷ���ʽ��_________________��
��2�������ݳ�����ɫ������_______________��
��3�����ڢ��е�ʵ������ͬѧ�������²⣬��������ʵ�飺
��ȡ���еĺ���ɫ��Һ�������������������ữ��BaCl2��Һ��������ɫ������ �ó����ۣ�FeCl3��Na2SO3������������ԭ��Ӧ�����ӷ���ʽ��______________��
������Ϊ��ʵ�鲻�Ͻ���������Ʋ�����ʵ�飬֤ʵ�˼Ľ�������ȷ�ġ���ʵ�鷽����ȡ����������Һ��������__________���ӵļ��顣
��4��������ʵ���������ͬѧ�Ƕ�pH��8��1mol/LNaF��Һ��FeCl3��Һ���ʱ����������˺��沢����ʵ�飺
ʵ����������� | ����2mL0.2mol/L FeCl3��Һ�е���2mL1mol/LNaF��Һ����Һ����ɫ |
����2mL0.2mol/L FeCl3��Һ�е���2mL����ˮ����Һ��ɫ��dz |
�ݵ�ʵ��Ŀ����___________��
��Ϊ̽��������Һ����ɫ��ԭ��������ʵ�飺
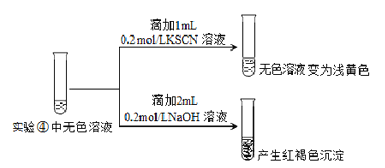
������ʾ��FeF3��ҺΪ��ɫ��
��ƽ���ƶ�ԭ�����ͺ��ɫ����������ԭ��_______________��
��5������ʵ�飬FeCl3��Һ���������֮��ķ�Ӧ�Ķ�������_____________________�йء�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3��Ϊһ����Ҫ����ԭ�ϣ�������Ӧ���ڹ�ҵ�����������й����ʷ�Ӧ�Ĵ����о������������863�ƻ���
(1)���������н�ǿ��ѡ���ԣ���רһ�ԡ���֪��
��ӦI��4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) ��H= -905.0 kJ��mol-1
4NO(g) +6H2O(g) ��H= -905.0 kJ��mol-1
��ӦII:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) ��H= -1266.6 kJ��mol-1
2N2(g) +6H2O(g) ��H= -1266.6 kJ��mol-1
д��NO�ֽ�����N2��O2���Ȼ�ѧ����ʽ_____��
(2)�ں��º���װ���г���һ������NH3��O2,��ij�����������½��з�ӦI ,��ò�ͬʱ���NH3��O2,��Ũ�����±���
ʱ��(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol��L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
�������й���������ȷ����_____________��
A.ʹ�ô���ʱ���ɽ��÷�Ӧ�Ļ�ܣ��ӿ��䷴Ӧ����
B.�����������4v��(NH3) =6v��(H2O)ʱ��˵����Ӧ�Ѵ�ƽ��
C.��������![]() =1ʱ��˵����Ӧ�Ѵ�ƽ��
=1ʱ��˵����Ӧ�Ѵ�ƽ��
D.ǰ10�����ڵ�ƽ������v( NO)=0.088 mol��L-1��min-1
(3)��������ʱ�ᷢ����������������ӦI��II��Ϊ����ij�����Ը÷�Ӧ��ѡ���ԣ���1L�ܱ������г���1 mol NH3��2mol O2������й����ʵ�����ϵ����ͼ��

�ٸô����ڵ���ʱѡ��Ӧ_______(� I ���� II������
��52��ʱ��4NH3+3O2![]() 2N2+6H2O��ƽ�ⳣ��K=_______(��Ҫ��ó���������ֻ���г����ּ���ʽ����
2N2+6H2O��ƽ�ⳣ��K=_______(��Ҫ��ó���������ֻ���г����ּ���ʽ����
��C���B����������NO�����ʵ����ٵ���Ҫԭ��________��
(4)�Ʊ�����ʱ������һ���ķ�Һ����ҵ�ϳ�������������ͳ�ȥ��Һ�е�Cu2+��
��֪��25��ʱ��K1(H2S) =1.3��10-7��K1(H2S) =7.1��10-15��Ksp(CuS) =8.5��10-45
���ڼ�����Һ�е�����Ũ��ʱ���漰����ĵ���ͨ��Ҫ���н��ƴ�������0.lmol L-1�������pH��______(ȡ������������
��ijͬѧͨ�����Ƽ��㷢��0.lmol L-1��������0.0lmol L-1�������е�c(S2-)��ȣ����ҵ���_____mol��L-1
����֪��ij��Һ�ӽ������ԣ������������������ᣬ����Һ��c(Cu2+) >_____ mol��L-1(������������λ��Ч���֣����ͻ����CuS������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ǿ������
A. 1������ԭ��ʧȥ���ӵĶ���
B. 1 mol�������ᷴӦ�ų������Ķ���
C. 1 mol����ʧȥ���ӵĶ���
D. ����ԭ��ʧȥ���ӵ����׳̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������CO2����ͨ��2Lδ֪Ũ�ȵ�NaOH��Һ�У���������Һ����μ���ϡ�������� ����������Һ���ȣ�������������HC1�����ʵ����Ĺ�ϵ��ͼ��ʾ������������ܽ��HCl�Ļӷ�)������˵������ȷ���ǣ� ��
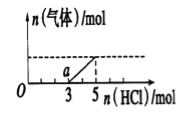
A��0����Һ���������ʵĻ�ѧʽΪNaOH��Na2CO3
B�������£�a����ҺpH>7
C����״���£�ͨ��CO2�����Ϊ4.48L
D��ԭNaOH��Һ�����ʵ���Ũ��Ϊ2.5mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com