
【题目】决定金属性强弱的是
A. 1个金属原子失去电子的多少
B. 1 mol金属与酸反应放出氢气的多少
C. 1 mol金属失去电子的多少
D. 金属原子失去电子的难易程度
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】为探究NH3的溶解性,某兴趣小组按如图所示装置进行实验
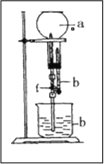
(f为止水夹)
请回答下列问题:
(1)写出实验室制取氨气的化学方程式 ___________________。
(2)要得到干燥的氨气可选用______ 作干燥剂。
A、浓硝酸 B、浓硫酸
C、碱石灰(CaO和NaOH的混合物) D、氢氧化钠溶液
(3)用如图装置进行喷泉实验,烧瓶中已装满干燥氨气,引发水上喷的操作是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是

A.液滴中的Cl― 由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-![]() 4OH-
4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-![]() Cu2+
Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10 mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则 ![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在化学晚会上表演如下魔术:用毛笔蘸取一种无色液体在一张白纸上书写了“化学魔术”四字,然后再喷上一种无色液体,白纸上立即出现了红色的“化学魔术”四字.该学生先后所用的无色液体可能是
A.石蕊溶液、稀硫酸 B.NaOH溶液、酚酞溶液
C.酚酞溶液、“雪碧”饮料 D.CuSO4溶液、NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol/L 的HA溶液中c(OH-)/c(H+)=1×10-8,下列叙述中正确的是( )
A.0.01 mol/L的HA溶液中c(H+)=1×10-4 mol/L
B.pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C.浓度均为0.1mol/L 的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则:c(OH-)-c(H+)<c(HA)-c(A-)
D.pH=3的HA溶液与pH=11的NaOH溶液按体积比1:10混合后所得溶液中:c(OH-)+c(A-)=c(H+)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石灰石—石膏法脱硫是除去工业烟气中所含SO2的重要方法,其工艺分为两步: —是吸收产生亚疏酸氢钙,二是氧化产生石膏。某校化学兴趣小组实验模拟该工艺,设计装置如下:

(1)装置B模拟产生含SO2的工业烟气,则E装置的作用是_______。
(2)实验开始时,打开装置B中分液漏斗的活塞,向烧瓶中逐滴滴加硫酸,D中立即产生了明显的现象,造成产生这一现象的原因是__________。
A.该装置的气密性不够好 B.滴加硫酸的速率较快
C.使用的硫酸浓度较小 D.石灰石浆液中碳酸钙粉末的顆粒太小
(3)预计当装置C中产生______的现象时,关闭装置B中分液漏斗的活塞,再点燃装置A处的酒精灯。实际实验过程中却始终未观察到C中产生这一现象,小组成员多次逬行实验探究,最终发现是药品Na2SO3部分变质,请写出定性实验发现药品Na2SO3问题的有关操作及现象:取少量的亚硫酸钠固体于试管中,_____________。
(4)小组成员进一步定量实验,测量Na2SO3的纯度:
①称取12.0 g Na2SO3固体配成l00 mL溶液,取25.00mL于锥形瓶中,并加入几滴淀粉溶液。
②用0.1000 mol L-1酸性KIO3溶液滴定,三次平行实验测得标准液的体积为20.00mL。则滴定终点时锥形瓶中产生的现象为_______,写出与产生终点现象有关反应的离子方程式________,样品中Na2SO3的质量分数为_________。(计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1×105 Pa和298 K时,将1 mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
共价键 | H-H键 | N三N键 | N-H键 |
键能(kJ·mol-1) | 436 | 945 | 391 |
工业合成氨的化学方程式:N2+3H2![]() 2NH3,
2NH3,
断开1 mol N2中的化学键需_____ (填“吸收”或“放出”)945 kJ能量,形成2 mol NH3中的化学键需_____ (填“吸收”或“放出”) ________ kJ能量;
在298 K时,取1 mol N2和3 mol H2放入一密闭容器中,在催化剂存在下进行反应。理论上放出或吸收的热量为Q1,则Q1为____________ kJ。
根据上表中的数据判断工业合成氨的反应是______(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000mol·L-1NaOH溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
A.盛装待测液的锥形瓶用蒸馏水洗过,没用待测液润洗
B.酸式滴定管在使用前未用待测液盐酸润洗
C.滴定前碱式滴定管尖嘴中有气泡,滴定后气泡消失
D.滴定前读数平视,滴定终点读数时俯视碱式滴定管的刻度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com