
【题目】石灰石—石膏法脱硫是除去工业烟气中所含SO2的重要方法,其工艺分为两步: —是吸收产生亚疏酸氢钙,二是氧化产生石膏。某校化学兴趣小组实验模拟该工艺,设计装置如下:

(1)装置B模拟产生含SO2的工业烟气,则E装置的作用是_______。
(2)实验开始时,打开装置B中分液漏斗的活塞,向烧瓶中逐滴滴加硫酸,D中立即产生了明显的现象,造成产生这一现象的原因是__________。
A.该装置的气密性不够好 B.滴加硫酸的速率较快
C.使用的硫酸浓度较小 D.石灰石浆液中碳酸钙粉末的顆粒太小
(3)预计当装置C中产生______的现象时,关闭装置B中分液漏斗的活塞,再点燃装置A处的酒精灯。实际实验过程中却始终未观察到C中产生这一现象,小组成员多次逬行实验探究,最终发现是药品Na2SO3部分变质,请写出定性实验发现药品Na2SO3问题的有关操作及现象:取少量的亚硫酸钠固体于试管中,_____________。
(4)小组成员进一步定量实验,测量Na2SO3的纯度:
①称取12.0 g Na2SO3固体配成l00 mL溶液,取25.00mL于锥形瓶中,并加入几滴淀粉溶液。
②用0.1000 mol L-1酸性KIO3溶液滴定,三次平行实验测得标准液的体积为20.00mL。则滴定终点时锥形瓶中产生的现象为_______,写出与产生终点现象有关反应的离子方程式________,样品中Na2SO3的质量分数为_________。(计算结果保留三位有效数字)。
【答案】 除去尾气中的SO2 B 由浑浊变澄清 先加适量的水溶解,再加入足量的盐酸与氯化钡溶液,有白色沉淀
生成。 当加入最后一滴酸性KIO3溶液时,溶液变蓝,且半分钟内不褪色 6H++5I-+IO3- = I2+3H2O 25.2%
【解析】(1)尾气中含有SO2对环境有污染,E装置中的NaOH溶液是吸收尾气中的SO2;
(2)D中立即产生了明显的现象,说明生成SO2的气流速率快,可能是滴加硫酸的速率较快,故答案B符合题意可选;
(3)石灰石浆悬浊液溶解于SO2的水溶液生成可溶性的亚疏酸氢钙,故当C中由浑浊变澄清时即可证明SO2已经过量,可关闭装置B中分液漏斗的活塞,再点燃装置A处的酒精灯,通入氧气;Na2SO3部分变质后生成硫酸钠,只要检验其水溶液中含有SO42-即可,即取少量的亚硫酸钠固体于试管中,先加适量的水溶解,再加入足量的盐酸与氯化钡溶液,有白色沉淀生成;
(4)在酸性条件下IO3-氧化SO32-生成SO42-,自身还原为I-,离子反应方程式为
IO3-+3SO32-=I-+3SO42-,继续滴加酸性KIO3溶液,溶液里的I-继续被IO3- 氧化为I2,此时溶液变蓝色,发生反应的离子方程式6H++5I-+IO3- = I2+3H2O,判断滴定终点的现象为当加入最后一滴酸性KIO3溶液时,溶液变蓝,且半分钟内不褪色;根据IO3-+3SO32-=I-+3SO42-,消耗KIO3的物质的量为0.1000 mol L-1×0.02L=2×10-3mol,则Na2SO3的物质的量为2×10-3mol×3=6×10-3mol,样品中Na2SO3的质量分数为![]() ×100%=25.2%;
×100%=25.2%;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B.一种烃在足量的氧气中燃烧并通过浓H2SO4,减少的体积就是生成的水蒸气的体积
C.某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减少,则y>4;否则y<4
D.相同质量的烃,完全燃烧,消耗O2越多,烃中含氢元素的质量分数就越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反应II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
写出NO分解生成N2与O2的热化学方程式_____。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I ,测得不同时间的NH3和O2,的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述中正确的是_____________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3) =6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均速率v( NO)=0.088 mol·L-1·min-1
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:

①该催化剂在低温时选择反应_______(填“ I ”或“ II”)。
②52℃时,4NH3+3O2![]() 2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
③C点比B点所产生的NO的物质的量少的主要原因________。
(4)制备催化剂时常产生一定的废液,工业上常利用氢硫酸检测和除去废液中的Cu2+。
已知:25℃时,K1(H2S) =1.3×10-7,K1(H2S) =7.1×10-15,Ksp(CuS) =8.5×10-45
①在计算溶液中的离子浓度时,涉及弱酸的电离通常要进行近似处理。则0.lmol L-1氢硫酸的pH≈______(取近似整数)。
②某同学通过近似计算发现0.lmol L-1氢硫酸与0.0lmol L-1氢硫酸中的c(S2-)相等,而且等于_____mol·L-1
③已知,某废液接近于中性,若加入适量的氢硫酸,当废液中c(Cu2+) >_____ mol·L-1(计算结果保留两位有效数字),就会产生CuS沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定金属性强弱的是
A. 1个金属原子失去电子的多少
B. 1 mol金属与酸反应放出氢气的多少
C. 1 mol金属失去电子的多少
D. 金属原子失去电子的难易程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如右图所示装置。试回答下列问题:
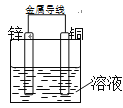
(1)若电解质溶液为稀硫酸,则Zn棒为原电池的______极(填“正”或“负”),发生_______反应(填“氧化”或“还原”), 电极反应式为___________________;Cu棒上可观察到的现象是______________________,电极反应式为______________________________。
(2)若电解质为硫酸铜溶液,则Cu棒为原电池的______极(填“正”或“负”),发生_________反应(填“氧化”或“还原”),其电极反应式为____________________________________。
(3)若在上述两个过程中,Zn棒减少的质量相等,则Cu棒上(1)和(2)所析出物质的质量之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 75%的酒精常用作环境消毒剂
B. 煤进行气化和液化加工可获得清洁燃料
C. 蚕丝和油脂都属于天然高分子化合物
D. 合成纤维和光导纤维都是新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO46H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:
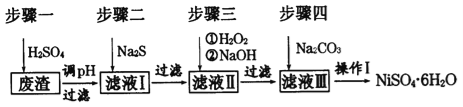
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取速率可采取的措施有_____________(任写一点)。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式:_______________。
(3)上述流程中滤液Ⅲ的主要成分是___________。
(4)确定步骤四中Na2CO3溶液足量,碳酸镍己完全沉淀的简单实验方法是______________。
(5)操作I的实验步骤依次为(实验中可选用的试剂:溶液、蒸馏水、pH试纸):
①_______________;
②_______________;
③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体
④ 用少量乙醇洗涤NiSO4·6H2O晶体并晾干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过 量,并将溶液加热,产生的气体与HC1的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
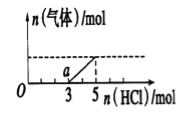
A.0点溶液中所含溶质的化学式为NaOH、Na2CO3
B.常温下,a点溶液pH>7
C.标准状况下,通入CO2的体积为4.48L
D.原NaOH溶液的物质的量浓度为2.5mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com