
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过 量,并将溶液加热,产生的气体与HC1的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
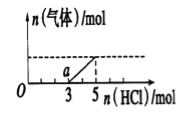
A.0点溶液中所含溶质的化学式为NaOH、Na2CO3
B.常温下,a点溶液pH>7
C.标准状况下,通入CO2的体积为4.48L
D.原NaOH溶液的物质的量浓度为2.5mol/L
【答案】C
【解析】
试题分析:A.Na2CO3跟盐酸的反应是分步进行的:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,HCl与Na2CO3、NaHCO3都按1:1反应,由图象可知生成二氧化碳消耗的HCl的物质的量小于从反应到开始产生二氧化碳阶段消耗的HCl,则溶液中溶质为NaOH、Na2CO3,A项正确;B.常温下,a点的溶液为NaHCO3溶液,碳酸氢钠溶液显碱性,所以pH>7,B项正确;C.由图可知,a点时开始生成气体,发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,至生成二氧化碳体积最大时,该阶段消耗的HCl的物质的量为2mol,由方程式可知产生二氧化碳的物质的量为2mol,生成的二氧化碳的物质的量等于开始通入的二氧化碳的物质的量,开始通入的二氧化碳的体积为2mol×22.4L/mol=44.8L,C项错误;D.加入5molHCl生成二氧化碳体积最大,此时溶液中溶质为NaCl,根据氯离子守恒有n(NaCl)=n(HCl),根据钠离子守恒有n(NaOH)=n(NaCl),n(NaOH)=n(HCl)=5mL,所以c(NaOH)=5mol÷2L=2.5mol/L,D项正确;答案选D。


科目:高中化学 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是

A.液滴中的Cl― 由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-![]() 4OH-
4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-![]() Cu2+
Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石灰石—石膏法脱硫是除去工业烟气中所含SO2的重要方法,其工艺分为两步: —是吸收产生亚疏酸氢钙,二是氧化产生石膏。某校化学兴趣小组实验模拟该工艺,设计装置如下:

(1)装置B模拟产生含SO2的工业烟气,则E装置的作用是_______。
(2)实验开始时,打开装置B中分液漏斗的活塞,向烧瓶中逐滴滴加硫酸,D中立即产生了明显的现象,造成产生这一现象的原因是__________。
A.该装置的气密性不够好 B.滴加硫酸的速率较快
C.使用的硫酸浓度较小 D.石灰石浆液中碳酸钙粉末的顆粒太小
(3)预计当装置C中产生______的现象时,关闭装置B中分液漏斗的活塞,再点燃装置A处的酒精灯。实际实验过程中却始终未观察到C中产生这一现象,小组成员多次逬行实验探究,最终发现是药品Na2SO3部分变质,请写出定性实验发现药品Na2SO3问题的有关操作及现象:取少量的亚硫酸钠固体于试管中,_____________。
(4)小组成员进一步定量实验,测量Na2SO3的纯度:
①称取12.0 g Na2SO3固体配成l00 mL溶液,取25.00mL于锥形瓶中,并加入几滴淀粉溶液。
②用0.1000 mol L-1酸性KIO3溶液滴定,三次平行实验测得标准液的体积为20.00mL。则滴定终点时锥形瓶中产生的现象为_______,写出与产生终点现象有关反应的离子方程式________,样品中Na2SO3的质量分数为_________。(计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1×105 Pa和298 K时,将1 mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
共价键 | H-H键 | N三N键 | N-H键 |
键能(kJ·mol-1) | 436 | 945 | 391 |
工业合成氨的化学方程式:N2+3H2![]() 2NH3,
2NH3,
断开1 mol N2中的化学键需_____ (填“吸收”或“放出”)945 kJ能量,形成2 mol NH3中的化学键需_____ (填“吸收”或“放出”) ________ kJ能量;
在298 K时,取1 mol N2和3 mol H2放入一密闭容器中,在催化剂存在下进行反应。理论上放出或吸收的热量为Q1,则Q1为____________ kJ。
根据上表中的数据判断工业合成氨的反应是______(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子或离子的立体构型判断不正确的是 ( )。
A.NH4+和CH4都是正四面体形
B.CO2和CS2都是直线形
C.NCl3和BCl3都是三角锥形
D.H2O和H2S都是V形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从樟科植物枝叶提取的精油中含有甲、乙两种成分:
![]()
![]()
(1)①用酸性高锰酸钾溶液检验甲和乙中含有碳碳双键,方案是否可行 填“可行”或“不可行”)。
②请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式 。
a.苯环上有两个不同的取代基
b.能与Br2的CCl4溶液发生加成反应
c.遇FeCl3溶液呈现紫色
(2)由甲转化为乙的过程为(已略去无关产物):

步骤Ⅰ的反应类型为 ,Y的结构简式 ,设计步骤Ⅰ的目的是 。
(3)1 mol乙最多可与 mol H2发生加成反应。
(4)写出乙与新制Cu(OH)2悬浊液反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000mol·L-1NaOH溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
A.盛装待测液的锥形瓶用蒸馏水洗过,没用待测液润洗
B.酸式滴定管在使用前未用待测液盐酸润洗
C.滴定前碱式滴定管尖嘴中有气泡,滴定后气泡消失
D.滴定前读数平视,滴定终点读数时俯视碱式滴定管的刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知一氧化碳与水蒸气的反应为: CO(g) + H2O(g)![]() CO2(g) + H2(g)
CO2(g) + H2(g)
在427 ℃ 时的平衡常数是9。如果反应开始时,一氧化碳和水蒸气的浓度都是0. 01 mol/L,则一氧化碳在此反应条件下的转化率为___________。
(2)规律是对经常出现的客观现象的归纳。规律越普遍,适用性或预言性也就越强,然而,任何规律都有其适用范围。
① 某同学在实验中发现,将H2S气体通入CuSO4溶液中,生成了黑色沉淀。请写出反应的化学方程式 ____________。
② 酸性强弱除与物质的本性有关外,还与溶剂有关,如CH3COOH与HF在液氨中可完全电离。在液氨中,反应CH3COONa + HCl = NaCl + CH3COOH _______(填“能”或“不能”)发生,理由是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com