
����Ŀ��NiSO46H2O��һ����ɫ������ˮ�ľ��壬�㷺���ڻ�ѧ������������صȣ����ɵ�Ʒ������������⣬�����У�Cu��Zn��Fe��Cr�����ʣ�Ϊԭ�ϻ�á�������������ͼ��
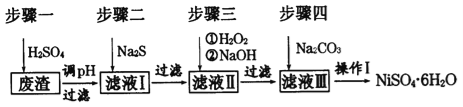
��ش��������⣺
��1����ϡ�����ܽ����ʱ��Ϊ����߽�ȡ���ʿɲ�ȡ�Ĵ�ʩ��_____________(��дһ��)��
��2������Һ�е���������Na2S��Һ��Ŀ���dz�ȥCu2+��Zn2+��д����ȥCu2+�����ӷ���ʽ:_______________��
��3��������������Һ�����Ҫ�ɷ���___________��
��4��ȷ����������Na2CO3��Һ������̼��������ȫ�����ļ�ʵ�鷽����______________��
��5������I��ʵ�鲽������Ϊ(ʵ���п�ѡ�õ��Լ�����Һ������ˮ��pH��ֽ)��
��_______________��
��_______________��
������Ũ������ȴ�ᾧ�����˵�NiSO4��6H2O����
�� �������Ҵ�ϴ��NiSO4��6H2O���岢����
���𰸡���1�����Ȼ�������������Ũ�ȵȣ���2��Cu2++S2-=CuS����
��3��Na2SO4��NiSO4����4���ϲ���Һ����ɫ��
��5���ٹ��ˣ���������ˮϴ����������������м�6mol/L��H2SO4��Һ��ֱ��ǡ����ȫ�ܽ�
��������
�����������1�����ݻ�ѧ��Ӧ���ʵ�Ӱ�����أ���ϡ�����ܽ����ʱ��Ϊ����߽�ȡ���ʿɲ�ȡ�Ĵ�ʩ�м��Ȼ�������������Ũ�ȵȡ�
��2������Na2S��������CuS��������Ӧ�����ӷ���ʽΪCu2++S2-=CuS����
��3����������������Na2S��H2O2��NaOH��ɳ�ȥCu��Zn��Fe��Cr�����ʣ���Һ�к�����������������ΪNa2SO4��NiSO4��
��4����ΪNiSO46H2O��һ����ɫ������ˮ�ľ��壬����ȷ����������Na2CO3��Һ������̼��������ȫ�����ļ�ʵ�鷽�����ϲ���Һ����ɫ��
��5���������ǽ���Һ�е�̼��������ת����NiSO46H2O�����Բ���I��ʵ�鲽������Ϊ�ٹ��ˣ���������ˮϴ����������������м�6mol/L��H2SO4��Һ��ֱ��ǡ����ȫ�ܽ⣻������Ũ������ȴ�ᾧ�����˵�NiSO4��6H2O���壻���������Ҵ�ϴ��NiSO4��6H2O���岢���ɡ�


 ������������Ծ�ϵ�д�
������������Ծ�ϵ�д� �������Ӳ�ϵ�д�
�������Ӳ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�̼�������仯�����ת�����ڻ����ĸ������ش����塣
��1��������ԭ������NOx��ת�����£�![]()
��֪��NO(g)+O3(g)=NO2(g)+O2(g) ��H=-200.9kJ/mol
2NO(g)��O2(g)=2NO(g) ��H=-116.2kJ/mol
��ӦI���Ȼ�ѧ����ʽΪ________________��
��2���������뽫CO�����з�Ӧ��ȥ��2CO(g)=2C(s)+O2(g) ��H>0����������������ܷ�ʵ�֣�______����ǡ���) ��������_____________��
��3��һ�������£�CO�����ĩ״�����������������ɼ����ơ���֪����ʱ������ĵ���ƽ�ⳣ��Ka=1.70��10-4��
�� �����Ƶ�ˮ��Һ�ʼ��ԣ��������ӷ�Ӧ����ʽ��ʾ��ԭ��___________��
�� ��20mL 0.1mol/L�ļ�������Һ�еμ�10ml 0.1mol/L�����ᣬ���Һ��______�ԣ���ᡱ�������Һ������Ũ�ȴӴ�С��˳��Ϊ______________��
��4������̿Ҳ�����ڴ�������β���е�NO����2L�����ܱ������м���0.1000molNO��2.030mol�������̿������A��B�������壬�ڲ�ͬ�¶��²��ƽ����ϵ�и����ʵ����ʵ������±���
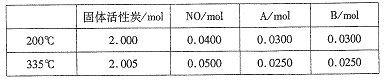
�ٸ÷�Ӧ������ӦΪ________(����ȡ����ȡ�)��Ӧ��
�� 200��ʱ��ƽ���������������ٳ���0.1molNO���ٴ�ƽ���NO�İٷֺ�����_____�������������С�����䡱����
�ۼ��㷴Ӧ��ϵ��335�� ʱ��ƽ�ⳣ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ���ڻ�ѧ�����ϱ�������ħ������ë��պȡһ����ɫҺ����һ�Ű�ֽ����д������ѧħ�������֣�Ȼ��������һ����ɫҺ�壬��ֽ�����������˺�ɫ������ѧħ�������֣���ѧ���Ⱥ����õ���ɫҺ�������
A��ʯ����Һ��ϡ���� B��NaOH��Һ����̪��Һ
C����̪��Һ����ѩ�������� D��CuSO4��Һ��NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ��ʯ��ʯ�෨�����dz�ȥ��ҵ����������SO2����Ҫ�������乤�շ�Ϊ������ �������ղ�����������ƣ�������������ʯ�ࡣijУ��ѧ��ȤС��ʵ��ģ��ù��գ����װ�����£�

(1)װ��Bģ�������SO2�Ĺ�ҵ��������Eװ�õ�������_______��
(2)ʵ�鿪ʼʱ����װ��B�з�Һ©���Ļ���������ƿ����εμ����ᣬD���������������Ե�������ɲ�����һ�����ԭ����__________��
A.��װ�õ������Բ����� B.�μ���������ʽϿ�
C.ʹ�õ�����Ũ�Ƚ�С D.ʯ��ʯ��Һ��̼��Ʒ�ĩ���w��̫С
(3)Ԥ�Ƶ�װ��C�в���______������ʱ���ر�װ��B�з�Һ©���Ļ������ٵ�ȼװ��A���ľƾ��ơ�ʵ��ʵ�������ȴʼ��δ�۲쵽C�в�����һ����С���Ա����J��ʵ��̽�������շ�����ҩƷNa2SO3���ֱ��ʣ���д������ʵ�鷢��ҩƷNa2SO3������йز���������ȡ�������������ƹ������Թ���,_____________��
(4)С���Ա��һ������ʵ�飬����Na2SO3�Ĵ��ȣ�
�ٳ�ȡ12.0 g Na2SO3�������l00 mL��Һ��ȡ25.00mL����ƿ�У������뼸�ε�����Һ��
����0.1000 mol L-1����KIO3��Һ�ζ�������ƽ��ʵ���ñ�Һ�����Ϊ20.00mL����ζ��յ�ʱ��ƿ�в���������Ϊ_______��д��������յ������йط�Ӧ�����ӷ���ʽ________����Ʒ��Na2SO3����������Ϊ_________��(������������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ����˵������A�Ƚ���B�Ļ��ǿ����( )��
A.Aԭ�ӵ�������������Bԭ�ӵ�������������
B.Aԭ�ӵ��Ӳ�����Bԭ�ӵ��Ӳ�����
C.1 mol A�������û�����H2��1 mol B�������û�����H2��
D.����ʱ,A�ܴ�ϡ�������û�����,��B���ܺ�ϡ���ᷢ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��105 Pa��298 Kʱ����1 mol��̬AB���ӷ������̬Aԭ�Ӻ�Bԭ������Ҫ��������Ϊ����(kJ��mol��1)��������һЩ���ۼ��ļ��ܣ�(��֪���������������ȼ۵ĵ���ۼ�)
���ۼ� | H-H�� | N��N�� | N-H�� |
����(kJ��mol��1) | 436 | 945 | 391 |
��ҵ�ϳɰ��Ļ�ѧ����ʽ��N2��3H2![]() 2NH3��
2NH3��
�Ͽ�1 mol N2�еĻ�ѧ����_____ (����ա��ų���)945 kJ�������γ�2 mol NH3�еĻ�ѧ����_____ (����ա��ų���) ________ kJ������
��298 Kʱ��ȡ1 mol N2��3 mol H2����һ�ܱ������У��ڴ��������½��з�Ӧ�������Ϸų������յ�����ΪQ1����Q1Ϊ____________ kJ��
�����ϱ��е������жϹ�ҵ�ϳɰ��ķ�Ӧ��______(����ȡ����ȡ�)��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԷ��ӻ����ӵ����幹���жϲ���ȷ���� (����)��
A��NH4����CH4��������������
B��CO2��CS2����ֱ����
C��NCl3��BCl3����������
D��H2O��H2S����V��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������У������ý�������ṹ���Խ��͵���
A. ���� B. ���� C. ����չ�� D. ����ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪������Ľṹ��ͼ��ʾ�����ڿ������������ȷ���ǣ���______��
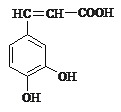
A������ʽΪC9H5O4
B��1 mol ������������5 mol ���������ӳɷ�Ӧ
C������ˮ���ܷ���ȡ����Ӧ�����ܷ����ӳɷ�Ӧ
D��1 mol ������������3 mol Na2CO3������Ӧ
��2��A��B��C��D1��D2��E��F��G��H��Ϊ�л���������������ͼʾ�ش����⡣
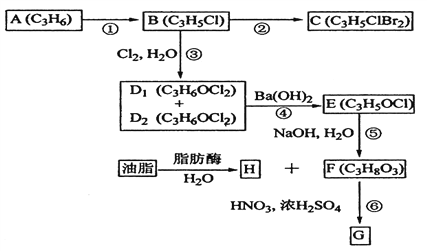
��1��ֱ���л�������A�Ľṹ��ʽ��__________________��
��2��B�й����ŵ�����Ϊ___________��H�к��������ŵĽṹ��ʽΪ____________��
��3���ٵķ�Ӧ�Լ��ͷ�Ӧ������___________________���۵ķ�Ӧ������_____________��
��4��B����C�Ļ�ѧ����ʽ��___________________��
D1��D2����E�Ļ�ѧ����ʽ��___________________��
��5��G��Ӧ����ҽ�ơ����Ƶȣ���F����G�Ļ�ѧ����ʽ��________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com