
【题目】下列各组性质比较中,不正确的是( )
A.元素最高化合价:Al>Mg
B.金属性:Al>Mg
C.酸性:H2SO4>H3PO4
D.稳定性:HF>HCl
科目:高中化学 来源: 题型:
【题目】(I)某同学设计实验探究构成原电池的条件,装置如下:
实验一:实验探究电极的构成〈甲图〉
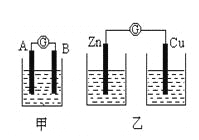
①A、B 两极均选用石墨作电极,发现电流计指针不偏转;② A、B 两极均选用铜片作电极,发现电流计指针不偏转;③ A极用锌片,B极用铜片,发现电流计指针向左偏转;④ A极用锌片,B极用石墨,发现电流计指针向左偏转。
结论一:____________________________________。
实验二:探究溶液的构成〈甲图,A极用锌片,B极用铜片)
①液体采用无水乙醇,发现电流计指针不偏转;
②改用硫酸溶液,发现电流计指针偏转,B极上有气体产生。
结论二 :____________________________________。
实验三:对比实验,探究乙图装置能否构成原电池
将锌、铜两电极分别放入稀硫酸溶液中,发现锌片上有气泡产生,铜片上无明显现象,电流计指针不发生偏转。
结论三:____________________________________。
思考:对该同学的实验,同学乙提出了如下疑问,请你帮助解决。
(1)在甲图装置中,若A 为镁片,B为铝片,电解质溶液为NaOH溶液,电流计的指针应向_______偏转。
(2)一根金属丝两端分别放在图乙的两个烧杯之中,电流计指针_______(填“能”或“不能”)偏转。
(II)依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设计的原电池如图所示。
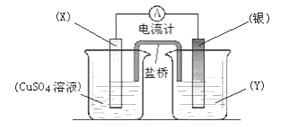
请回答下列问题:(1)电极X的材料是_________;电解质溶液Y是_________;
(2)当电路中转移0.01mol电子时,两电极的质量差为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,其中丙中实验现象描述正确的是
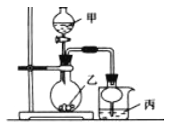
实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
A | 70%硫酸 | Na2SO3 | 紫色石蕊试液 | 溶液先变红后褪色 |
B | 浓盐酸 | KMnO4 | 含酚酞的NaOH溶液 | 溶液褪色 |
C | 稀盐酸 | CaCO3 | BaCI2溶液 | 有白色沉淀生成 |
D | 浓氨水 | CaO | AlCl3 | 先生成白色沉淀然后沉淀溶解 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
序号 | 反应温度/℃ | C(H2O2)/mol-L | V(H2O2)/mL | M(MnO2)/g | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
(1)设计实验2和实验3的目的是研究_______对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验_____和实验____作对比(填序号)。
(3)将实验1和实验2作对比,t1____t2(填“>”、“<”或“=”)。
II.以KI和FeCl3反应为例(2Fe3++2I-![]() 2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:①0.1mol·L-1KI溶液 ②0.1mol·L-1 FeCl3溶液③0.1mol·L-1 FeCl2溶液 ④0.1mol·L-1 HCl溶液⑤0.1mol·L-1 FeSCN溶液⑥ CCl4
2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:①0.1mol·L-1KI溶液 ②0.1mol·L-1 FeCl3溶液③0.1mol·L-1 FeCl2溶液 ④0.1mol·L-1 HCl溶液⑤0.1mol·L-1 FeSCN溶液⑥ CCl4
实验步骤:
(1)取5mL0.1mol·L-1KI溶液,再滴加几滴0.1mol·L-1 FeCl3溶液
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂_______(填序号),现象___________,说明此反应存在一定的限度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O],又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90%,碳酸钙10%)碳化法制取:
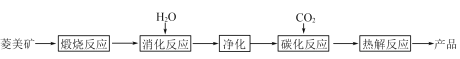
(1)根据下列表格数据,选择消化反应的最佳温度__________;理由是___________________________。
消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为____________。
(3)流程图中__________和__________可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol·L-1时,可以认为完全除去。常温时当调节溶液PH为9.5时,此时Mn2+小于__________mol·L-1,不会沉淀出来。
物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为__________。
A.Ca(ClO)2 B.Cl2 C.H2O2 D.HNO3
③下列方案中,较好的为__________,理由是______________________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PTT是近几年来迅速发展起来的新型热塑性聚酯材料,具有优异性能,能作为工程塑料、纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为:

其中A、B、C均为链状化合物,A能发生银镜反应,B中不含甲基。请回答下列问题:
(1)A、B的结构简式分别为 、 。
(2)C中是否含有手性碳原子 。(填“含有”或“不含有”)
(3)写出一种满足下列条件的A的同系物的结构简式 。
①分子式为C4H6O ②含有1个-CH3
(4)1 mol C可与足量钠反应生成 L H2(标准状况)。
(5)由物质C与D反应生成PTT的化学方程式为 ,反应类型为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究NH3的溶解性,某兴趣小组按如图所示装置进行实验
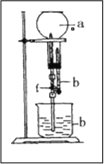
(f为止水夹)
请回答下列问题:
(1)写出实验室制取氨气的化学方程式 ___________________。
(2)要得到干燥的氨气可选用______ 作干燥剂。
A、浓硝酸 B、浓硫酸
C、碱石灰(CaO和NaOH的混合物) D、氢氧化钠溶液
(3)用如图装置进行喷泉实验,烧瓶中已装满干燥氨气,引发水上喷的操作是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,影响一定质量气体体积大小的决定因素是( )
A.气体的密度 B.气体分子体积的大小
C.气体分子间的平均距离 D.气体的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10 mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则 ![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com