
【题目】(I)某同学设计实验探究构成原电池的条件,装置如下:
实验一:实验探究电极的构成〈甲图〉
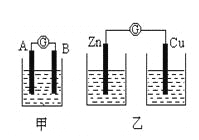
①A、B 两极均选用石墨作电极,发现电流计指针不偏转;② A、B 两极均选用铜片作电极,发现电流计指针不偏转;③ A极用锌片,B极用铜片,发现电流计指针向左偏转;④ A极用锌片,B极用石墨,发现电流计指针向左偏转。
结论一:____________________________________。
实验二:探究溶液的构成〈甲图,A极用锌片,B极用铜片)
①液体采用无水乙醇,发现电流计指针不偏转;
②改用硫酸溶液,发现电流计指针偏转,B极上有气体产生。
结论二 :____________________________________。
实验三:对比实验,探究乙图装置能否构成原电池
将锌、铜两电极分别放入稀硫酸溶液中,发现锌片上有气泡产生,铜片上无明显现象,电流计指针不发生偏转。
结论三:____________________________________。
思考:对该同学的实验,同学乙提出了如下疑问,请你帮助解决。
(1)在甲图装置中,若A 为镁片,B为铝片,电解质溶液为NaOH溶液,电流计的指针应向_______偏转。
(2)一根金属丝两端分别放在图乙的两个烧杯之中,电流计指针_______(填“能”或“不能”)偏转。
(II)依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设计的原电池如图所示。
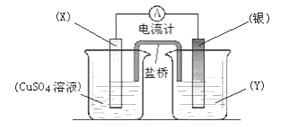
请回答下列问题:(1)电极X的材料是_________;电解质溶液Y是_________;
(2)当电路中转移0.01mol电子时,两电极的质量差为 g。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碳酸亚铁(FeCO3)是菱镁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3生成Fe2O3。
I.已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393 kJ/mol 2FeCO3(s)=2Fe(s)+ 3O2(g) △H=+148OkJ/mol
(1)请写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式_______。
Ⅱ.生成的FeO和Fe2O3在一定条件下被还原为金属铁。
(2)据报道一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
① 原子序数为26的铁元素位于元素周期表的第_______周期。
②反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量消耗4.8g。则该段时间内用H2表达的平均反应速率为____________。
③将一定量的Fe2O3(s)和一定量的CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是___________。
a.CH4的转化率等于CO的产率 b.混合气体的平均相对分子质量不变
c.v正(CO):v逆(H2)=1:2 d.固体的总质量不变
(3)FeO可用CO进行还原,已知:t℃时,FeO(s)+CO(g)![]() Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Ⅲ. Fe2O3还可用来制备FeCl3,FeCl3在水溶液中的水解分三步:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++ H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++ H2O![]() Fe (OH)3+H+ K3
Fe (OH)3+H+ K3
(4)以上水解反应的平衡常效K1、K2、K3由大到小的顺序是_______。通过控制条件,以上水解产物聚合生成聚合物的离子方程式为:xFe3++yH2O===Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是__________(填字母)
a.加水稀释 b.加入少量NaCl固体 c.升温 d.加入少量Na2CO3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890kJ·mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是( )
A. 1∶1 B. 1∶3 C. 1∶4 D. 2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究金属的腐蚀与防护,设计如图所示装置。下列叙述不正确的是:

A.若X为碳棒,为减缓铁的腐蚀,开关K应置于N处
B.若X为碳棒,开关K置于M处,会加快铁的腐蚀
C.若X为锌,开关K置于M处,就是牺牲阳极的阴极保护法
D.若X为锌,开关K置于N处,铁电极发生的反应为Fe-2e- =Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g液态甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为: 。
(2)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量。写出1mol N2和O2完全反应的热化学方程式为: 。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:2SO2(g)+ O2(g)= 2SO3(g) △H =-196.6kJ·mol-1
2NO(g)+O2=2NO2(g) △H =-113.0kJ·mol-1
则反应NO2(g)+SO2(g)=SO3(g)+NO(g)的△H = __________。
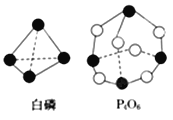
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:E(P-P)=198kJ·mol-1、E(P-O)=360kJ·mol-1、E(O=O)=498kJ·mol-1,则反应P4(白磷)燃烧生成P4O6的热化学方程式为:___________________。
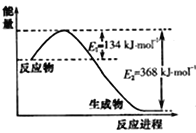
(3)如图是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,请写出NO2和 CO反应的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 蛋白质和糖类的水解都是高分子生成小分子的过程
B. 甲苯分子中所有原子均处在同一个平面上
C. 溴水与乙烯发生加聚反应而褪色
D. 天然气和液化石油气的主要成分都是烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含氮化合物对能源、环保和生产具有重要的意义。请回答下列问题:
(1)在2 L密闭容器内, 800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①如图所示A点处v正___(填“>”、“<”或“=”,下同)v逆,A点处v正___B点处v正。
②如图所示的曲线,其中表示NO2的变化的曲线是________(填a、b、c、d等字母)。用O2表示2 s内该反应的速率v=________。
(2)已知化学反应N2+3H2![]() 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,
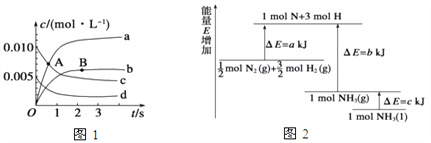
则,1 mol N和3 mol H生成1 mol NH3(g)是______能量的过程(填“吸收”或“释放”),由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组性质比较中,不正确的是( )
A.元素最高化合价:Al>Mg
B.金属性:Al>Mg
C.酸性:H2SO4>H3PO4
D.稳定性:HF>HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com