
【题目】氮及其化合物在工农业生产中具有重要作用。
(1)某小组进行工业合成氨N2(g)+3H2(g)![]() 2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。

实验②从开始到达到平衡状态的过程中,用H2表示的平均反应速率为 。与实验①相比,.实验②所采用的实验条件可能为 (填字母),实验③所采用的实验条件可能为 (填字母)。
a.增大压强b.减小压强c.升高温度d.降低温度e.使用催化剂
(2)NH3可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是 (填字母)
2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是 (填字母)
a.升高温度 b.增大压强 c,增大NH3的浓度
(3)NCl3遇水发生水解反应,生成NH3的同时得到 (填化学式)。ClO2是广谱高效消毒剂,制备原理为NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-。若转移1mol电子,则制取ClO2的质量为 。
(4)25℃时,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“>”、“<”或“=”)。用a、b表示NH3·H2O的电离平衡常数为 。
【答案】(12分)(1)0.012mol/(Lmin)(2分) e(1分) c(1分) (2)c(2分)
(3)HClO(1分) 67.5(2分) (4)>(1分) ![]() mol/L(2分)
mol/L(2分)
【解析】
试题分析:(1)根据图像可知,实验②中反应进行到10min到达平衡状态,平衡时氮气的物质的量浓度减少了=0.1mol/L-0.06mol/L=0.04mol/L。根据方程式可知,氢气的浓度变化量△c(H2)=3△c(N2)=3×0.04mol/L=0.12mol/L,所以υ(H2)=![]() =0.012mol/(Lmin);根据图像可知,与实验①相比,实验②到达平衡所用时间比较短,反应速率较快,但平衡时氮气的浓度不变,即改变条件平衡不移动。由于该反应正反应是气体体积减小的反应,故实验②的条件应是使用了催化剂,答案选e;根据图像可知,与实验①相比,实验③到达平衡所用时间也比较短,反应速率较快,但平衡时氮气的浓度增大,这说明改变体积平衡向逆反应移动。由于该反应正反应是体积减小的放热反应,因此实验③所采用的实验条件是升高温度,答案选c。
=0.012mol/(Lmin);根据图像可知,与实验①相比,实验②到达平衡所用时间比较短,反应速率较快,但平衡时氮气的浓度不变,即改变条件平衡不移动。由于该反应正反应是气体体积减小的反应,故实验②的条件应是使用了催化剂,答案选e;根据图像可知,与实验①相比,实验③到达平衡所用时间也比较短,反应速率较快,但平衡时氮气的浓度增大,这说明改变体积平衡向逆反应移动。由于该反应正反应是体积减小的放热反应,因此实验③所采用的实验条件是升高温度,答案选c。
(2)提高废气中氮氧化物的转化率,应改变条件使平衡向正反应移动,则:
a.该反应正反应是放热反应,升高温度,平衡向逆反应移动,氮氧化物的转化率降低,故a错误;
b.该反应正反应是体积增大的反应,增大压强,平衡向逆反应移动,氮氧化物的转化率降低,故b错误;c.增大NH3的浓度,平衡向正反应移动,氮氧化物的转化率增大,故c正确,答案选c。
(3)NCl3遇水发生水解反应生成NH3,这说明NCl3分子中负价原子结合水电离的H+,因此正价原子结合水电离的OH-,所以生成NH3的同时还得到HClO;反应中只有氯元素的化合价发生变化,氯元 素由NCl3中+1降低为Cl-中-1价,得到电子;由ClO2-中+3价升高为ClO2中+4价,失去1个电子,即每生成1molClO2,反应中就转移1mol电子。所以当转移1mol电子时,生成ClO2的物质的量为1mol,质量为1mol×67.5g/mol=67.5g。
(4)溶液显中性,所以c(H+)=c(OH-)。根据溶液的电荷守恒可得:c(H+)+c(NH4+)=c(Cl-)+ c(OH-),因此c(NH4+)=c(Cl-)。氯化铵是强酸弱碱盐,NH4+水解,其水溶液呈酸性,因此要使氯化铵溶液呈中性,则氨水应稍微过量。因为盐酸和氨水的体积相等,则氨水的物质的量浓度大于盐酸,即a>b;溶液中c(H+)=c(OH-)=10-7mol/L,c(NH4+)=c(Cl-)=0.5bmol/L,所以c(NH3H2O)=0.5amol/L-0.5bmol/L。电离常数只与温度有关,则此时NH3H2O的电离常数Kb=![]() =
=![]() mol/L.。
mol/L.。


科目:高中化学 来源: 题型:
【题目】在容积均为1 L的三个密闭容器中,分别放入铁粉并充入1 mol CO,控制在不同温度下发生反应:Fe(s)+5CO(g) ![]() Fe(CO)5(g),当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是( )
Fe(CO)5(g),当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是( )
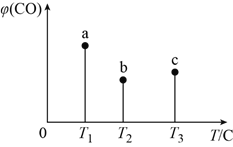
A. 反应进行到5min时,b容器中v(正)=v(逆)
B. 正反应为吸热反应,平衡常数:K(T1)>K(T2)
C. b中v(正)大于a中v(逆)
D. 达到平衡时,a、b、c中CO的转化率为b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①Cl2②KCl③NaHCO3④浓H2SO4⑤NH3⑥Al(OH)3。用序号填空:
(1)只由离子键构成的是_______。
(2)有刺激性气味,且能使酚酞溶液变红的是_______。
(3)常温常压下呈黄绿色的气体是_______。
(4)实验室常用作干燥剂的是_______。
(5)与强酸和强碱溶液都能发生反应、且没有气体产生的是_______。
(6)化学性质不稳定、在一定条件下易分解生成三种物质的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃。在空气中强烈发烟,易与水发生水解反应。人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。在熔融的硫中通入氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装 置均已略去)。

(1)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式_______;
(2)装置a的作用为_______;装置c为何水平放置_______;
(3)该实验的操作顺序应为_______(用序号表示);
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(4)f装置中应放置的试剂为_______,其作用为________;
(5)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是:
A. 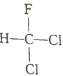 和
和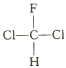 互为同分异构体
互为同分异构体
B. 15g甲基(﹣CH3)含有的电子数是9NA
C. 7.8g苯中含有的碳碳双键数为0.3NA
D. 标准状况下,2.24 L CCl4中的原子总数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
加入的物质 | 结论 | |
A | 50mL 1 mol/LH2SO4 | 反应结束后,c(Na+)=c(SO42-) |
B | 0.05molCaO | 溶液中c(OH-) /c(HCO3-) 增大 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH—)不变 |
D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的浓度(不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为
A. 0.4 mol B. 0.5 mol C. 0.6 mol D. 0.8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨和水类似,也能电离:NH3+NH3![]() NH4++NH2-,25℃时,其离子积K=1.0×10-30。现将2.3g金属钠投入1.0L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中粒子关系不正确的是(设温度保持不变,溶液体积为1L)
NH4++NH2-,25℃时,其离子积K=1.0×10-30。现将2.3g金属钠投入1.0L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中粒子关系不正确的是(设温度保持不变,溶液体积为1L)
A. c(NH4+)=1.0×10-29molL-1 B. c(Na+)=c(NH2-)
C. c(NH2-)>c(NH4+) D. c(NH4+) c(NH2-)=1.0×10-30
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请在标有序号的空白处填空:以下是与绿色化学、环境保护和人类健康息息相关的三个主题,请根据已知信息回答有关问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是(可多选)__________。
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl→CH3CH2Cl+H2O
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2=CHCl+H2![]() CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性高的是__________反应(填反应类型)。
(2)有毒物质的无害化也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,还可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性酸根离子氧化除去。请写出用ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式________,并说明该方法的优点_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com