
【题目】请在标有序号的空白处填空:以下是与绿色化学、环境保护和人类健康息息相关的三个主题,请根据已知信息回答有关问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是(可多选)__________。
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl→CH3CH2Cl+H2O
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2=CHCl+H2![]() CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性高的是__________反应(填反应类型)。
(2)有毒物质的无害化也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,还可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性酸根离子氧化除去。请写出用ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式________,并说明该方法的优点_______。
【答案】AD加成2ClO2+2CN-=2CO2↑+N2↑+2Cl-产物为无毒的气体(CO2和N2)
【解析】
(1)A、CH2=CH2+HCl→CH3CH2Cl中所有原子都转化成了所需产物,原子利用率100%,A符合;
B、CH3CH2OH+HCl→CH3CH2Cl+H2O中除目标产物CH3CH2Cl外,还有水生成,原子利用率不是100%,B不符合;
C、CH3CH3+Cl2![]() CH3CH2Cl+HCl中除目标产物CH3CH2Cl外,还有HCl生成,原子利用率不是100%,C不符合;
CH3CH2Cl+HCl中除目标产物CH3CH2Cl外,还有HCl生成,原子利用率不是100%,C不符合;
D、H2=CHCl+H2![]() CH3CH2Cl中所有原子都转化成了所需产物,原子利用率100%,D符合;答案选AD;
CH3CH2Cl中所有原子都转化成了所需产物,原子利用率100%,D符合;答案选AD;
由上述四个反应可归纳出,原子经济性高的是加成反应;
(2)将CN-氧化成无毒的CO2和N2两种气体,而ClO2被还原为Cl-,根据原子守恒、电荷守恒可知离子反应方程式为2ClO2+2CN-=2CO2↑+N2↑+2Cl-。根据方程式可知产物为无毒的气体(CO2和N2)不污染环境。


科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产中具有重要作用。
(1)某小组进行工业合成氨N2(g)+3H2(g)![]() 2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。

实验②从开始到达到平衡状态的过程中,用H2表示的平均反应速率为 。与实验①相比,.实验②所采用的实验条件可能为 (填字母),实验③所采用的实验条件可能为 (填字母)。
a.增大压强b.减小压强c.升高温度d.降低温度e.使用催化剂
(2)NH3可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是 (填字母)
2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是 (填字母)
a.升高温度 b.增大压强 c,增大NH3的浓度
(3)NCl3遇水发生水解反应,生成NH3的同时得到 (填化学式)。ClO2是广谱高效消毒剂,制备原理为NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-。若转移1mol电子,则制取ClO2的质量为 。
(4)25℃时,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“>”、“<”或“=”)。用a、b表示NH3·H2O的电离平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】野外被蚊虫叮咬会出现红肿,这是由甲酸(HCOOH)造成的。请完成下列探究。
I . HCOOH 酸性探究
(1)下列酸属于二元酸的有___________。
a.HCOOH b.H2CO3 c.H2C2O4 d.CH3CHOHCH2COOH
(2)下列实验事实能证明甲酸为弱酸的是___________。
a.HCOONH4溶液呈酸性
b.将甲酸滴入![]() 溶液中有气体生成
溶液中有气体生成
C.常温下,0.1mol·L-1的甲酸溶液的pH约为3
d.等浓度的盐酸与甲酸溶液。前者的导电能力更强
(3)可用小苏打溶液处理蚊虫叮咬造成的红肿,请用离子方程式表示其原理_________。
Ⅱ甲酸制备甲酸铜探究
相关原理和化学方程式如下:
先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后碱式碳酸铜再与甲酸反应制得四水甲酸铜![]() 晶体:
晶体:
![]()
![]()
实验步骤如下:
(4)碱式碳酸铜的制备:
![]()
①步骤ⅰ是将一定量![]() 晶体和
晶体和![]() 固体一起放到研钵中研细并混合均匀。
固体一起放到研钵中研细并混合均匀。
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,温度不能过高的原因是________________________________。
③步骤ⅱ的后续操作有过滤、洗涤等。检验沉淀是否已洗涤干净的方法为________。
(5)甲酸铜晶体的制备:
将Cu(OH)2CuCO3固体放入烧杯中,加入一定量的热蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的三分之一时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体 2~3 次,晾干,得到产品。
①“趁热过滤”中,必须“趁热”的原因是_________________。
②用乙醇洗涤晶体的目的是________________________________。
③若该实验所取原料 CuSO45H2O 晶体和 NaHCO3 固体的质量分别为12.5 g 和9.5 g,实验结 束后,最终称量所得的产品为 7.91 g,则产率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关分子结构如图所示,下列叙述中,正确的是 ( )
![]()
A. 除苯环外的其余碳原子有可能都在一条直线上
B. 所有的原子都在同一平面上
C. 12个碳原子不可能都在同一平面上
D. 12个碳原子有可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,有一组H2C2O4和NaOH的混合溶液,其中c (H2C2O4) +c (HC2O4)+c (C2O42-)=0.1mol/L,溶液中部分微粒的物质的量浓度随pH 的变化如图所示。[电离度=( 已电离电解质分子数/原弱电解质分子数) x 100%] 下列说法不正确的是
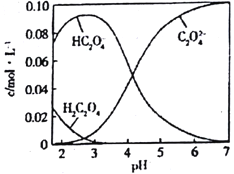
A. H2C2O4的Ka2数量级为10-5
B. 在NaHC2O4溶液中,c (Na+)>c(HC2O4)>c (H+)>c(C2O42-)>c (OH-)
C. 0.1mol/L 的H2C2O4溶液,H2C2O4的电离度约为80%
D. pH=7.0的溶液中,c (Na+)=0.1+c(C2O42-)-c (H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳樟醇和橙花叔醇是决定茶叶花甜香的关键物质。芳樟醇和橙花叔醇的结构如图所示,下列有关叙述正确的是

A. 橙花叔醇的分子式为C15H28O
B. 芳樟醇和橙花叔醇互为同分异构体
C. 芳樟醇和橙花叔醇与H2完全加成后的产物互为同系物
D. 二者均能发生取代反应、加成反应、还原反应,但不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系

据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应
B. 白磷比红磷稳定
C. ①S(g)+O2(g)=SO2(g);②S(s)+O2(g)=SO2(g);放出热量:①②
D. CO(g)+H2O(g)=CO2(g)+ H2 (g);该反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,第(2) ~ (3)小题用元素符号或化学式回答,(4)~(6)小题按题目要求回答。
族 周期 | I A | Ⅱ A | Ⅲ A | Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A | O |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | F | H | I |
(1)表中元素,化学性质最不活泼的原子结构示意图是___________,非金属性最强的元素在周期表中的位置是__________________________,
(2)最高价氧化物的水化物中碱性最强的是_________,酸性最强的是___________,
(3)A分别与D、E、G形成的最简单化合物中,最不稳定的_______________,
(4)A和E组成最简单化合物的电子______________
(5)在B、C、F、G的简单离子中,离子半径由大到小的顺序是__________________,
(6)由A的单质与O2构成的燃料电池中,在E的最高价氧化物对应水化物的条件下进行,写出正极的电极反应式______________________________________。
(7)当B的最高价氧化物的水化物与C的最高价氧化物反应后,向所得溶液中通入过量D的最高价氧化物的离子方程式___________________________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲用98%的浓H2SO4(ρ=1.84g/cm3)配制500mL 0.5molL﹣1的稀H2SO4。
(1)填写下列操作步骤:
①所需浓H2SO4的体积为______。
②如果实验室有10mL、20mL、50mL量筒,应选用______mL量筒量取。
③将量取的浓H2SO4沿内壁慢慢注入盛有约100m 水的烧杯里,并不断搅拌,目的是______。
④立即将上述溶液沿玻璃棒注入______中,并用50mL蒸馏水洗涤烧杯2~3次,并将洗涤液注入其中,并不时轻轻振荡。
⑤加水至距刻度线______处,改用______加水,使溶液的凹液面最低点正好跟刻度线相平。盖上瓶塞,上下颠倒数次,摇匀。
(2)请指出上述操作中一处明显错误______。
(3)误差请分析以下错误操作对所配制的溶液浓度的影响(填“偏高”“偏低”或“无影响”)。
①若进行操作⑤定容时,眼睛俯视,则所配制溶液的浓度将______。
②问题(2)的错误操作将导致所配制溶液的浓度______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com