
����Ŀ���Ȼ���S2Cl2����һ�ֻƺ�ɫҺ�壬�д̼��ԡ���Ϣ�Զ�����۵�Ϊ��80�棬�е�137.1�档�ڿ�����ǿ�ҷ��̣�����ˮ����ˮ�ⷴӦ������ʹ������������ʹ�����ı������ȷ�ճ���Ӳ�IJ������ܡ������ڵ�����ͨ��������������S2Cl2����ͼ��ʵ������S��Cl2�Ʊ�S2Cl2��װ�ã��г�װ�á�����װ �þ�����ȥ����

��1����֪S2Cl2���ӽṹ��H2O2���ƣ���д��S2Cl2�ĵ���ʽ_______��
��2��װ��a������Ϊ_______��װ��cΪ��ˮƽ����_______��
��3����ʵ��IJ���˳��ӦΪ_______������ű�ʾ����
�ټ���װ��c ��ͨ��Cl2 ��ͨ����ˮ ��ֹͣͨCl2 ��ֹͣ����װ��c
��4��fװ����Ӧ���õ��Լ�Ϊ_______��������Ϊ________��
��5����֪S2Cl2ˮ��ʱ��ֻ��һ��Ԫ�صĻ��ϼ۷����˱仯���ұ������ͱ���ԭ�ĸ�Ԫ�ص����ʵ���֮��Ϊ1��3����д���÷�Ӧ�Ļ�ѧ����ʽ________��
���𰸡�![]() ����������ֹ���ڵ���������ܢڢۢ٢ݢܣ���ۢڢ٢ݢܣ���ʯ������Cl2β��������ֹ�����е�ˮ��ʹS2Cl2ˮ��2S2Cl2+2H2O��SO2��+3S��+4HCl
����������ֹ���ڵ���������ܢڢۢ٢ݢܣ���ۢڢ٢ݢܣ���ʯ������Cl2β��������ֹ�����е�ˮ��ʹS2Cl2ˮ��2S2Cl2+2H2O��SO2��+3S��+4HCl
��������
��1��S2Cl2���ӽṹ��H2O2���ƣ�S2Cl2��������ԭ������ԭ��֮���γ�1�Թ��õ��Ӷԣ���ԭ������ԭ��֮���γ�1�Թ��õ��Ӷԣ�S2Cl2����ʽΪ![]() ��
��
��2������Ϣ��֪S2Cl2��ˮˮ�⣬����b�е�����Ӧ�ø����Ũ������a��Ӧ���Լ�ΪŨ���ᣬ������Ϊ��������������۵�ϵͣ����������ڻ���װ��cˮƽ���÷�ֹ���ڵ���������ܣ�
��3������֮ǰ��ͨ����ˮ������ʼ���ɵ�S2Cl2������ȴҺ���������ֹͣ���Ⱥ�ֹͣͨ������ƽ��������ѹǿ����ֹ����Σ�գ�����ʵ�����˳��Ϊ�ڢۢ٢ݢܣ���ۢڢ٢ݢܣ���
��4�������ж���Fװ��ʢ�ż�ʯ�ң�����Cl2β������ֹ��Ⱦ������ͬʱ��ֹ�����е�ˮ������e��ʹS2Cl2ˮ�⣻
��5��ֻ����Ԫ�ػ��ϼ۷����仯���ұ������ͱ���ԭ�����ʵ���֮��Ϊ1��3�����ݵ��ӵ�ʧ�غ��֪���������Ƕ�������ԭ����������ԭ���غ��֪�����Ȼ������ɣ���Ӧ�Ļ�ѧ����ʽΪ2S2Cl2+2H2O��SO2��+3S��+4HCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪���ټ����ȼ����Ϊ ��H=��890.3 kJ/mol
��2H2(g)+O2(g)=2H2O(l) ��H=��517.6 kJ/mol
��2CO(g)+O2(g)=2CO2(g) ��H=��566kJ/mol
������һ����������CO2��Ӧ�Ʊ��ϳ�����CO��H2������ʵ�ֱ��Ϊ��������CO2���ŷţ��÷�Ӧ���Ȼ�ѧ����ʽΪ_____________________________________________
��2��ȼ�ϵ����Ӧ�ù㷺�����͵�أ���������ȼ�ϵ��ʾ��ͼ����Ҫ����д���缫��Ӧʽ
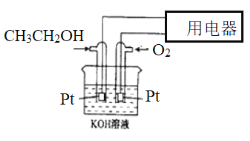
�������ĵ缫��Ӧʽ____________________________________________��
�ڵ������Һ��pH_____________�����������С�����䡱)��
�۵���·��ת��0.4mol����ʱ�����������ı�״����O2�����Ϊ__________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�ϼ�ʽ̼��þ[4MgCO3��Mg(OH)2��4H2O],�ֳ�����̼��þ����������þ������������Ϊ̼��þ90%,̼���10%��̼������ȡ��
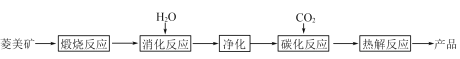
��1���������б�������,ѡ��������Ӧ������¶�__________;������___________________________��
�����¶�/�� | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
ת����/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
��2��̼����Ӧ������Mg(HCO3)2,����Mg(HCO3)2�Ļ�ѧ����ʽΪ____________��
��3������ͼ��__________��__________����Ϊ̼����Ӧ�ṩ������̼Դ��
��4���й����������±ˮ̼������ȡ����̼��þ��
��±ˮ�к���Fe2+��Mn2+,����Ũ��С��1��10-5mol��L-1ʱ,������Ϊ��ȫ��ȥ������ʱ��������ҺPHΪ9.5ʱ,��ʱMn2+С��__________mol��L-1,�������������
���� | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
�������Fe2+ת��ΪFe3+,�ӻ����Ƕ�ѡ������ʵ�������Ϊ__________��
A��Ca(ClO)2 B��Cl2 C��H2O2 D��HNO3
�����з�����,�Ϻõ�Ϊ__________��������______________________��
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��һ�ֱ�ɫ�۾��ľ�Ƭ����ͨ����й⽺Ƭ�к���±��������Ƭ�仯���� Ϊ±�����ڹ�������·�����ѧ��Ӧ���䷴Ӧʽ��_______ ������й⽺Ƭ�ع� �Ļ�ѧ��Ӧ��_______��
��2�����ҹ��ɺ����صĻ������������������÷ɻ������ڻ��������ع��������֧���в����⻯����AgI����ɱ���ʵ���˹����꣨���˹���ѩ�����ﵽ���ֵ�Ŀ�ģ������й��˹�����������У�����Ϊ�������ǵ���_______��
A������ũҵ���������ʹ��������ĸ�����һ����Ч��
B����ʹ�õĵ⻯���е��ؽ���Ԫ�ض����������Ⱦ
C����ʹ�õ� AgI �绻�ɸɱ����ɱ����ؽ���Ԫ�ض���������Ⱦ
D�����������սʤ��Ȼ�ı��֣����������������������ģ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2H2��g��+CO��g��![]() CH3OH��g��Ϊ���ȷ�Ӧ���Ը÷�Ӧ������˵����ȷ���ǣ� ��
CH3OH��g��Ϊ���ȷ�Ӧ���Ը÷�Ӧ������˵����ȷ���ǣ� ��
A. ��÷�ӦΪ���ȷ�Ӧ���ʲ����ȾͿɷ���
B. ��ͬ�����£�2 mol H2��������1 mol CO������һ������1 mol CH3OH������
C. ��ͬ�����£���Ӧ��2 mol H2��1 mol CO��������һ������������1 mol CH3OH��������
D. �ﵽƽ��ʱ��CO��Ũ����CH3OH��Ũ��һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2SiO3�Ļ�ѧʽ�ɸ�д��Na2OSiO2�������ʵķ���Ƕ�����Na2SiO3���ڣ�
A. ����� B. ������ C. �� D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ڹ�ũҵ�����о�����Ҫ���á�
��1��ijС����й�ҵ�ϳɰ�N2(g)��3H2(g)![]() 2NH3(g) ��H��0��ģ���о�����1L�ܱ������У��ֱ����0.1mol N2��0.3mol H2��ʵ��������������c��N2����ʱ�䣨t���ı仯��ͼ��ʾ��
2NH3(g) ��H��0��ģ���о�����1L�ܱ������У��ֱ����0.1mol N2��0.3mol H2��ʵ��������������c��N2����ʱ�䣨t���ı仯��ͼ��ʾ��

ʵ�����ӿ�ʼ���ﵽƽ��״̬�Ĺ����У���H2��ʾ��ƽ����Ӧ����Ϊ ����ʵ������ȣ���ʵ���������õ�ʵ����������Ϊ ������ĸ����ʵ���������õ�ʵ����������Ϊ ������ĸ����
a������ѹǿb����Сѹǿc�������¶�d�������¶�e��ʹ�ô���
��2��NH3�����ڴ��������еĵ�������䷴Ӧԭ��Ϊ2NH3(g)��NO(g)��NO2(g)![]() 2N2(g)��3H2O(g) ��H��0����߷����е��������ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ������ĸ��
2N2(g)��3H2O(g) ��H��0����߷����е��������ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ������ĸ��
a�������¶� b������ѹǿ c������NH3��Ũ��
��3��NCl3��ˮ����ˮ�ⷴӦ������NH3��ͬʱ�õ� ���ѧʽ����ClO2�ǹ���Ч���������Ʊ�ԭ��ΪNCl3��6ClO2����3H2O=NH3����6ClO2��3OH����3Cl������ת��1mol���ӣ�����ȡClO2������Ϊ ��
��4��25��ʱ����amol��L-1�İ�ˮ��bmol��L-1����������ϣ���Ӧ����Һǡ�������ԣ���a b����������������������=��������a��b��ʾNH3��H2O�ĵ���ƽ�ⳣ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���ȣ�������緢���Ƚ������ĺ��������У�������Ӧ��2A(g)+B(s) ![]() C(g)+D(g)�������������ܱ�����Ӧ�Ѵﵽƽ��״̬���У� ����
C(g)+D(g)�������������ܱ�����Ӧ�Ѵﵽƽ��״̬���У� ����
���������¶Ȳ��� �ڻ��������ܶȲ��� �ۻ�������ѹǿ����
�ܻ�������ƽ����Է����������� ��C(g)�����ʵ���Ũ�Ȳ���
��������A��C��D���������Ũ��֮��Ϊ2��1��1 ��ijʱ��v(A)��2v(C)�Ҳ�������
�λʱ��������n mol D��ͬʱ����2n mol A
A. 4 B. 5 C. 6 D. 7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йط��ӽṹ��ͼ��ʾ�����������У���ȷ���� (����)
![]()
A. �������������̼ԭ���п��ܶ���һ��ֱ����
B. ���е�ԭ�Ӷ���ͬһƽ����
C. 12��̼ԭ�Ӳ����ܶ���ͬһƽ����
D. 12��̼ԭ���п��ܶ���ͬһƽ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com