
【题目】下列实验选用的用品一定不需要的是( )
A.碳酸钠溶液pH值测定(pH试纸)B.粗盐提纯(蒸发皿)
C.蒸馏自来水制蒸馏水(冷凝管)D.硝酸钾与食盐的分离(分液漏斗)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碲(Te)的单质和化合物在化工生产等方面具有重要应用。
(1)下列关于碲及其化合物的叙述不正确的是_______。
A.Te位于元素周期表的第五周期ⅣA族
B. Te的氧化物通常有TeO2和TeO3
C. H2TeO4的酸性比H2SO4酸性强
D.热稳定性H2Te比H2S弱,H2Te比HI强
(2)25℃时,亚碲酸(H2TeO3)的 ![]() = 1×10-3,
= 1×10-3, ![]() =2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为___________ (
=2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为___________ (![]() ); NaHTeO3的溶液的pH_______7(填“>”、“=”或“<”)。
); NaHTeO3的溶液的pH_______7(填“>”、“=”或“<”)。
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含有TeO2、少量Ag、Au)为原料制备单质碲,其工艺流程如下:

①“碱浸”时TeO2发生反应的化学方程式为 _________。
②“沉碲”时控制溶液的pH为4. 5~5. 0,生成Tea沉淀。酸性不能过强的原因是_________;防止局部酸度过大的操作方法是____________。
③“酸溶”后,将SO2通入TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是____________。
④工业上还可以通过电解铜阳极泥碱浸、过滤后的滤液得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中正确的是( )

A.图Ⅰ所示电池中,负极电极反应为Zn-2e-![]() Zn2+
Zn2+
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g)△H=一92kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=一92kJ/mol。实验测得起始、平衡时的有关数据如下表:

下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/3
C.容器②中达平衡时放出的热量Q=46 kJ
D.若容器①体积为2L,则平衡时放出的热量<46kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图甲装置电解一定量的CuSO4溶液,M、N为惰性电极.电解过程实验数据如图乙所示.X轴表示电解过程中转移电子的物质的量,Y轴表示电解过程产生气体的总体积。则下列说法不正确的是( )
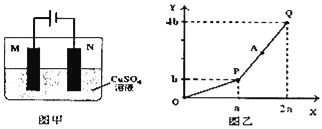
A. A点所得溶液只需加入一定量的CuO固体就可恢复到起始状态
B. 电解过程中N电极表面先有红色物质生成,后有气泡产生
C. Q点时M、N两电极上产生的气体总量在相同条件下体积相同
D. 若M电极材料换成Cu做电极,则电解过程中CuSO4溶液的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.钠和水反应Na+H2O=Na++OH-+H2↑
B.碳酸钙与稀盐酸反应:2H++CO32-=CO2↑+H2O
C.氯气溶于水的离子方程式为Cl2+H2O2H++Cl-+ClO-
D.碳酸氢钠溶液中加入醋酸:HCO3-+CH3COOH=CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构和性质的说法不正确的是
A. 分子式为C5H10且与乙烯互为同系物的结构共有5种
B. 可用燃烧法鉴别环乙烷、苯、CCl4
C. 分子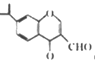 中所有碳原子不可能位于同一平面
中所有碳原子不可能位于同一平面
D. 三联苯![]() 与四联苯
与四联苯![]() 互为同系物
互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com