
【题目】某羧酸酯的分子式为C14H26O4,1mol该酯完全水解可得到1mol丁二酸和2mol某种一元醇X,该一元醇X的结构(不包括立体异构)可能有( )
A. 7种B. 8种C. 9种D. 10种
科目:高中化学 来源: 题型:
【题目】将体积均为V0的三种溶液分别加水稀释至体积为V时,pH与V0/V的关系如下图所示:

下列说法正确的是
A. 酸性:HX>HY
B. HX溶液滴定NaOH溶液时指示剂用甲基橙比用酚酞误差小
C. “HX+NaX-混合溶液中,V0/V=10-1时,c(HX)<c(X-)
D. V0/V在10-1~10-3,“HX+NaX”混合溶液随V0/V的减小,X-的水解与HX的电离程度始终保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C和H2在生产、生活、科技中是重要的燃料。
①2C(s)+O2(g)= 2CO(g) △H=-220kJ/mol
②
下列推断正确的是( )
A. C(s)的燃烧热110kJ/mol
B. 2H2 (g) +O2 (g) =2H2O (g) △H=+480kJ/mol
C. C(s) +H2O(g)==CO(g) +H2 (g) △H=-220kJ/mol
D. 分解2molH2O(1),至少需要4×462kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《太平惠民和剂局方》中对精制蜡的过程有如下记载:“……先将蜡六两熔化作汁,以重绵滤去滓,以好酒一升,于银石器内煮蜡熔,数沸倾出,候酒冷,其蜡自浮,取蜡称用。”文中涉及的操作方法是( )
A. 萃取B. 升华C. 重结晶D. 渗析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁制容器盛装冷的浓硫酸.为研究铁制材料与热的浓硫酸的反应,某学习小组进行了以下探究活动.
(1)【探究一】
Ⅰ.将已除去表面氧化物的铁钉(碳素钢)放入冷的浓硫酸中,10min后投入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 .
Ⅱ.另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+ . 若要确认其中是否含有Fe2+ , 应选用(填序号).
a.KSCN溶液和新制氯水
b.铁粉和KSCN溶液
c.浓氨水
d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O═2HBr+H2SO4 , 然后加入足量BaCl2溶液,经适当操作后,得2.33g干燥固体.由此推知气体Y中SO2的体积分数为 .
(2)【探究二】
分析上述实验中所得SO2的体积分数,丙同学认为气体Y中还可能含有H2和Q气体.为此设计了如图所示的探究实验装置(图中夹持仪器已省略).
①装置B中试剂的作用是 .
②认为气体Y中还可能含有Q的理由是(用化学方程式表示).
③为确认Q的存在,需添加装置M于(填序号).
a.装置A之前 b.装置A、B间
c.装置B、C间 d.装置C、D间
④如果气体Y中含有H2 , 实验现象应是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质.
某化学小组在实验室中利用简易装置进行了铝和氧化铁的反应,发现生成的铁呈疏松多孔的褐色硬块.该小组成员认为主要原因是产生的铁中含有较多杂质,请你参与探究该褐色硬块的组成.
(1)首先将褐色硬块处理成粉末,通过实验来确定是否含有单质铝,经实验首先排除了铝的存在,则该小组成员在该实验中选用的试剂是 , 证明不含铝的实验现象为 .
(2)经初步确定后,可认为褐色硬块除Fe外,还含有Fe2O3、Al2O3 , 为验证其组成该小组设计如下流程: 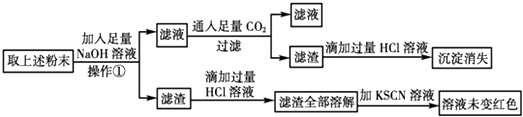
①在上述流程中,操作①所用到的玻璃仪器有 .
②通过上述实验该小组得出结论:该褐色硬块中除铁外,一定含有Al2O3 , 不含Fe2O3 , 你认为该结论是否可靠(填“是”或“否”),理由是(用离子方程式和必要的文字进行说明).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸。原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子,乳酸的摩尔质量为90g/mol,下列有关说法中正确的是( )

A. 电极a为阴极,放出H2
B. 通电一段时间后,硫酸溶液的pH升高
C. A-通过阴离子交换膜从阴极进入浓缩室
D. 对400mLl0g/L乳酸溶液通电后,当外电路通过0.5mole-时浓度,上升为145g.L-1(溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是( )
A. Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2═2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对此Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
(1)真空碳热还原一氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlC13(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJmol﹣1
3AlCl(g)═2Al(l)+AlC13(g)△H=b kJmol﹣1
用含a、b的代数式表示反应:Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=_____kJmol﹣1.
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=Q kJmol﹣1.在T1℃时,反应进行到不同时间测得各物质的浓度如下(时间单位为min,浓度单位为mol/L):
| 0 | 10 | 20 | 30 |
NO | 1.00 | 0.68 | 0.50 | 0.50 |
N2 | 0 | 0.16 | 0.25 | 0.25 |
CO2 | 0 | 0.16 | 0.25 | 0.25 |
①0~10min内,NO的平均反应速率v(NO)=_____,T1℃时,该反应的平衡常数K=_____.
②30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q_____0(填“>”、“<”或“═”)
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是_____ (填选项编号).
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol/L,则反应平衡时c(NO)=_____mol/L.NO的转化率_____(填“增大”、“减小”或“不变”).
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题,将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图.电极b表面发生的电极反应式为_____.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com