
【题目】碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
(1)真空碳热还原一氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlC13(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJmol﹣1
3AlCl(g)═2Al(l)+AlC13(g)△H=b kJmol﹣1
用含a、b的代数式表示反应:Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=_____kJmol﹣1.
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=Q kJmol﹣1.在T1℃时,反应进行到不同时间测得各物质的浓度如下(时间单位为min,浓度单位为mol/L):
| 0 | 10 | 20 | 30 |
NO | 1.00 | 0.68 | 0.50 | 0.50 |
N2 | 0 | 0.16 | 0.25 | 0.25 |
CO2 | 0 | 0.16 | 0.25 | 0.25 |
①0~10min内,NO的平均反应速率v(NO)=_____,T1℃时,该反应的平衡常数K=_____.
②30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q_____0(填“>”、“<”或“═”)
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是_____ (填选项编号).
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol/L,则反应平衡时c(NO)=_____mol/L.NO的转化率_____(填“增大”、“减小”或“不变”).
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题,将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图.电极b表面发生的电极反应式为_____.

【答案】 a+b 0.032 molL﹣1min﹣1 0.25 < cd 1.25 不变 CO2+2H++2e﹣=HCOOH
【解析】试题分析:(1)①Al2O3(s)+AlC13(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJmol﹣1;②3AlCl(g)═2Al(l)+AlC13(g)△H=b kJmol﹣1,①+②得:Al2O3(s)+3C(s)=2Al(l)+3CO(g),所以△H=(a+b) kJmol﹣1.
(2)某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 0 | 10 | 20 | 30 |
NO | 1.00 | 0.68 | 0.50 | 0.50 |
N2 | 0 | 0.16 | 0.25 | 0.25 |
CO2 | 0 | 0.16 | 0.25 | 0.25 |
①0~10min内,NO的平均反应速率v(NO)=![]() 0.032 molL﹣1min﹣1,由表中数据可知,T1℃时,C(s)+2NO(g)N2(g)+CO2(g)在20min达到平衡,该反应的平衡常数K=
0.032 molL﹣1min﹣1,由表中数据可知,T1℃时,C(s)+2NO(g)N2(g)+CO2(g)在20min达到平衡,该反应的平衡常数K=![]() 0.25.
0.25.
②由表中数据可知,T1℃NO、N2、CO2的平衡浓度之比为2:1:1,30mi后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,说明升高温度该平衡向逆反应方向移动,所以该反应为放热反应, Q< 0。
③在恒容条件下,a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g),不能说明正反应速率和逆反应速率相等,无法判断是否达到平衡;b.反应前后气体的分子数不变,反应体系的压强一直不发生改变,所以反应体系的压强不再发生改变不能说明反应达到平衡;c.正反应有固体变为气体,所以混合气体的密度会变大 ,当混合气体密度保持不变时达到平衡;d.混合气体的平均相对分子质量是个变量,当混合气体的平均相对分子质量保持不变时达到平衡。所以能判断该反应一定达到化学平衡状态的依据是cd.
④若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol/L,
C(s)+2NO(g)N2(g)+CO2(g)
起始量(mol/L) 2.50 0 0
变化量(mol/L) 2x x x
平衡量(mol/L) 2.50-2x x x
K=![]() ,解之得x=
,解之得x=![]() ,则反应达平衡时c(NO)=
,则反应达平衡时c(NO)=![]() mol/L.转化率问题,相当于在原平衡的基础上增大压强,因为反应前后气体分子数不变,平衡不移动,所以NO的转化率不变.
mol/L.转化率问题,相当于在原平衡的基础上增大压强,因为反应前后气体分子数不变,平衡不移动,所以NO的转化率不变.
(3)由原理示意图可知,a电极上发生氧化反应,b电极上发生还原反应。总反应为2CO2+2H2O=2HCOOH+O2,由于使用的是质子交换膜(只允许H+通过),所以a极上发生2H2O-4e- =4H++O2,电极b表面发生的电极反应式为CO2+2H++2e﹣=HCOOH.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某羧酸酯的分子式为C14H26O4,1mol该酯完全水解可得到1mol丁二酸和2mol某种一元醇X,该一元醇X的结构(不包括立体异构)可能有( )
A. 7种B. 8种C. 9种D. 10种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无论是鲜重还是干重,组成细胞的元素中C、H、O、N这四种元素的含量最多,其中一种在干重中的含量达到55.99%,这表明构成细胞最基本的元素是
A. C B. H C. O D. N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为化学常见的纯净物,A是单质,它们之间有如下的反应关系:

(1)若B是气态氢化物,C、D是氧化物且C是造成酸雨的主要物质。B与C可反应生成A,写出该反应的化学方程式:___________________。
(2)若A是太阳能电池用的光伏材料,B为A单质的氧化物,C、D为钠盐,两种物质中钠、氧外的元素为同一主族。,写出B→C的离子方程式:__________。
(3)若B为淡黄色固体,②③反应均用到同一种液态氢化物,D物质常用于食品工业,写出B→C的化学方程式:__________。
(4)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体,写出C→D的离子方程式:__________。
(5)若A是应用最广泛的金属,④反应用到A,②⑤反应均用到同一种非金属单质。写出C→D的离子方程
式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在A(g)+B(g)═C(g)+D(g)的反应体系中,C的百分含量和时间的关系如图所示,若反应分别在400℃和100℃下进行,所得曲线分别为Q与P,则正反应是放热反应的图为( )
A.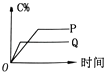
B.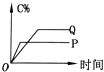
C.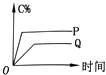
D.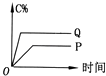
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在细胞内含量极少,但对维持生命活动必不可少的元素有( )
A. Fe、Mn、Zn、Mg B. Zn、Cu、Fe,Ca
C. Zn、Cu、B、Mn D. K、Mn、Cu、Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为VL的密闭容器中进行反应:aN(g)═bM(g),M、N的物质的量随时间的变化曲线如图所示. 
(1)该反应的化学方程式中 ![]() = .
= .
(2)t1~t2时间段,以M的浓度变化表示的平均反应速率为 .
(3)t2时,生成M的速率与消耗N的速率(填“相等”或“不相等”).
(4)下列叙述中能说明上述反应达到平衡状态的是 .
A.反应中M与N的物质的量之比为1:1
B.混合气体的总物质的量不随时间的变化而变化
C.单位时间内每消耗a mol N,同时生成b mol M
D.N的质量分数在混合气体中保持不变.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com