
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为: 2KClO3 +4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况:(单线桥法表示)________________________。
(2)氧化剂与还原剂的物质的量之比是 ___________________
(3)若产生标况下22.4 L Cl2,则转移的电子的物质的量为________mol。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸中HCl的物质的量浓度 mol·L-1。
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN- 等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN - 氧化,只生成两种气体,其离子反应方程式为为 ,处理100 m3这种污水,至少需要ClO2 _______mol。
【答案】(1)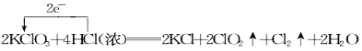 ;
;
(2)1:1;(3)2;(4)11.9;
(5)2ClO2+2CN-=N2+2CO2+2Cl-,50a/13(或3.85a)。
【解析】(1)根据氧化还原反应中的价态归中规律判断元素化合价只靠拢不交叉,所以氯酸钾中的氯元素化合价由+5降到二氧化氯中的+4价,盐酸中的氯元素由-1价升到0价,该反应中电子转移的情况为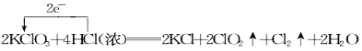 。
。
(2)2mol氯酸钾中的氯元素化合价全部由+5降到二氧化氯中的+4价,作氧化剂,4molHCl中的氯元素的化合价只有2mol由-1价升到0价,作还原剂,氧化剂与还原剂的物质的量之比是1:1。
(3)标况下22.4 L Cl2的物质的量为1mol,根据(1)知转移的电子的物质的量为2mol。
(4)根据公式c=![]() 计算质量分数为36.5%,密度为1.19 g·cm-3的浓盐酸中HCl的物质的量浓度为(1000×1.19×36.5%)÷36.5=11.9mol·L-1。
计算质量分数为36.5%,密度为1.19 g·cm-3的浓盐酸中HCl的物质的量浓度为(1000×1.19×36.5%)÷36.5=11.9mol·L-1。
(5)根据题意知ClO2将CN - 氧化生成二氧化碳和氮气,本身被还原为Cl-,利用化合价升降法配平,该反应的离子方程式为2ClO2 + 2CN- = N2 + 2CO2 + 2Cl- ,废水中CN- 的浓度为a mg/L,即为ag/m3,100 m3污水含CN-的质量为100ag,物质的量为100ag÷26g/mol=50a/13mol,根据反应方程式知至少需要ClO2 50a/13mol 。


科目:高中化学 来源: 题型:
【题目】下列有关金属的说法中正确的是( )
A. 钠在空气中燃烧只生成白色的氧化钠固体
B. 燃着的镁条伸入盛满二氧化碳的集气瓶中不能继续燃烧
C. 铜能与氯化铁溶液反应,该反应可以用于印刷电路板的制作
D. 铁能与硫酸发生反应,故不能用铁制容器贮存浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,氢氧化镁饱和溶液中存在如下关系:c(Mg2+)·c2(OH-)=Ksp。试推断氢氧化镁在下列溶液中的溶解度由大到小的顺序是
①0.1mol·L-1的AlCl3溶液②0.1mol·L-1的NH4Cl溶液
③0.1mol·L-1的KCl溶液④0.1mol·L-1的KAlO2溶液
A.①④③②
B.①②③④
C.③①④②
D.④①③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AgI为黄色沉淀,AgCl为白色沉淀。25°C时,AgI饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5mL含有KCl和KI浓度均为0.01mol·L-1的混合溶液中,滴加8mL0.01mol·L-1的AgNO3溶液,则下列叙述中不正确的是
A. 溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3—)>c(Cl-)>c(I-)>c(Ag+)
B. 溶液中先产生的是AgI沉淀
C. AgCl的Ksp的数值为1.69×10-10
D. 若在AgI悬浊液中滴加少量的KCl稀溶液,黄色沉淀不会转变成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列四种X溶液分别加入四个盛有10mL 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸和缓地进行反应.其中反应速率最大的是( )
A.20mL 3mol/L 的X溶液
B.20mL 2mol/L 的X溶液
C.10mL 4mol/L的X溶液
D.10mL 2mol/L的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据右表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )

A.c(HCO3-)>c(ClO-)>c(OH-)
B.c(ClO-)>c(HCO3-)>c(OH-)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.氯化铁腐蚀铜板:Fe3++Cu=Fe2++Cu2+
B.实验室制氯气:MnO2+4HCl(浓)![]() Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
C.稀硫酸中加氢氧化钡到溶液呈中性:Ba2++H++OH-+SO42-=BaSO4↓+H2O
D.氢氧化钠溶液中吸收少量二氧化硫:2OH-+SO2=SO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠的说法不正确的是( )
A.金属钠与O2反应,条件不同,产物不同
B.少量钠可保存在煤油中
C.金属钠质软,可以用小刀切割
D.由于钠很活泼,所以它能从水溶液中置换出金属活动性顺序表中排在钠后面的金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G和J是元素周期表中前20号的主族元素,其原子序数依次增大。已知:
①A和D为同主族元素,且A的单质是最轻的气体;
②B元素最高价氧化物的水化物与其气态氢化物反应生成盐;
③F、G相邻,C的核电荷数是F核外电子数的一半,F与J可形成离子化合物J2F;
④E元素是地壳中含量最多的金属元素。
完成下列填空:
(1)ACD三种元素共同形成的化合物的电子式为____________,其微粒间存在的化学键有____________;将这种化合物滴入EG两种元素形成的化合物溶液中,直至过量,总反应的离子方程式为__________________。
(2)E元素位于周期表的第____________周期____________族。
(3)铜与B元素最高价氧化物的水化物的浓溶液反应的离子方程式为_________________。
(4)F、G分别与A形成的化合物,还原性强的是_______(填写相应的化学式)。
(5)F简单阴离子的结构示意图_______,且F、G、J简单离子的半径由大至小的顺序是_______(填写相应离子符号)
(6)实验室制取单质G的化学方程式为____________________________,
比较F、G的最高价氧化物的水化物的酸性(填写相应化学式)_______>_______。
(7)一种燃料电池,以铂为电极插入KOH溶液中,分别向两极通入A单质和C单质。通入C单质的一极是_______极,电极反应式为:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com