
 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
分析 (1)由题目信息可知,高锰酸钾溶液在酸性、碱性条件下都会分解,且见光分解速度加快,故应避光保存配成中性溶液;
由题目信息可知,高锰酸钾在酸性条件下会分解生成二氧化锰和氧气,同时会生成水,据此书写离子方程式;
(2)根据化合价升降方法,反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,C2O42-→CO2,碳元素化合价由+3价升高为+4,共升高2价,化合价最小公倍数为10,故MnO4-系数为2,C2O42-系数为5,再根据元素守恒、电荷守恒确定其它物质的系数;
(3)反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好;
(4)①高锰酸钾具有强氧化性,可以发生碱式滴定管的橡皮管,故应用酸式滴定管盛放;
②逐滴滴入高锰酸钾溶液,待前一滴高锰酸钾溶液颜色褪去后再滴加,防止高锰酸钾在酸性条件下分解;
③依据消耗标准溶液的体积分析判断选项,c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$;
④令KMnO4溶液的浓度为c,根据方程式2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O计算.
解答 解:(1)由题目信息可知,高锰酸钾溶液在酸性、碱性条件下都会分解,且见光分解速度加快,故应盛放在棕色瓶中避光保存配成中性溶液;
由题目信息可知,高锰酸钾在酸性条件下会分解生成二氧化锰和氧气,同时会生成水,反应离子方程式为4MnO4-+4H+═4MnO2↓+3O2↑+2H2O,
故答案为:配成中性溶液并保存在棕色试剂瓶中;4MnO4-+4H+═4MnO2↓+3O2↑+2H2O;
(2)反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,C2O42-→CO2,碳元素化合价由+3价升高为+4,共升高2价,化合价最小公倍数为10,故MnO4-系数为2,C2O42-系数为5,再根据元素守恒可知Mn2+系数为2、CO2系数为10,根据电荷守恒可知H+系数为16,根据氢元素守恒可知H2O系数为8,配平后离子方程式为2MnO4-+5C2O42-+16H+=2Mn2++10CO2+8H2O,
故答案为:2;5;16;2;10;8H2O;
(3)反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好,
故答案为:反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好;
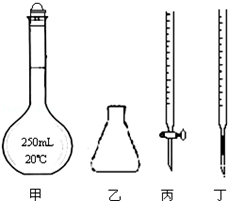
(4)①高锰酸钾具有强氧化性,可以发生碱式滴定管的橡皮管,故应用酸式滴定管盛放,故选择丙,故答案为:丙;
②防止高锰酸钾在酸性条件下分解,滴定时应逐滴滴入高锰酸钾溶液,待前一滴高锰酸钾溶液颜色褪去后再滴加,
故答案为:逐滴滴入高锰酸钾溶液,待前一滴高锰酸钾溶液颜色褪去后再滴加;
③用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度,c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$;
A.盛装KMnO4溶液的滴定管用水洗后,未用KMnO4溶液润洗,高锰酸钾溶液被稀释,高锰酸钾的物质的量偏小,测定的高锰酸钾的浓度偏低,故A符合;
B.滴定前尖嘴部分无气泡,滴定终点时出现气泡,导致高锰酸钾溶液的体积偏小,测定的高锰酸钾的浓度偏大,故B不符合;
C.定容时,俯视刻度线,导致高锰酸钾溶液的体积偏小,测定的高锰酸钾的浓度偏大,故C不符合;
D.锥形瓶用蒸馏水洗净后未用待测液润洗,对草酸的物质的量没有影响,故对测定的高锰酸钾的浓度无影响,故D不符合;
故答案为:A;
④n(C2O42-)=$\frac{1.34g}{134g/mol}$=0.01mol,则:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O计
2mol 5mol
c×0.02L×10 0.01mol
所以2mol:5mol=c×0.02L×10:0.01mol
解得c=0.02mol/L
故答案为:0.02mol/L.
点评 本题考查药品存放、氧化还原反应配平、氧化还原反应滴定应用、化学计算等,题目难度中等,注意把握实验的原理,需要学生具备一定的理论分析能力和计算解决问题的能力.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂.目前主要的合成方法有电解法、高温固相法等.
纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂.目前主要的合成方法有电解法、高温固相法等.| 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
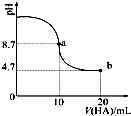 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(HA)>c(A-) | |
| B. | 当加入HA溶液10ml时,$\frac{{K}_{W}}{c({H}^{+})}$<1.0×10-7mol•L-1 | |
| C. | a点所示溶液中c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.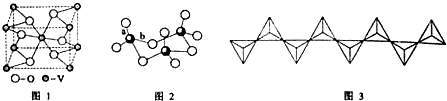
 (配位键须注明).
(配位键须注明).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com