
某合作学习小组讨论辨析以下说法
①粗盐和碱石灰都是混合物;
②沼气和水煤气都是可再生资源;
③冰和水混合物不是混合物而是纯净物;
④不锈钢和目前流通的硬币都是合金;
⑤盐酸和食醋既是化合物又是酸;
⑥纯碱和烧碱都是碱;
⑦豆浆和雾都是胶体。
上述说法正确的是
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
下列对一些实验事实的理论解释不正确的是
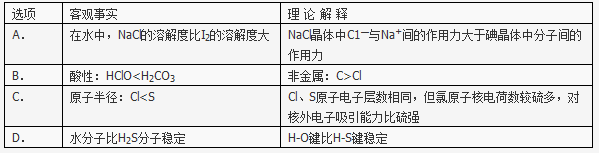
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知下面三个数据:7.2×10-4 mol·L-1、4.6×10-4 mol·L-1、4.9×10-10 mol·L-1分别是下列有关的三种酸的电离常数的数值,若已知下列反应可以发生:NaCN+HNO2===HCN+NaNO2 NaCN+HF===HCN+NaFNaNO2+HF===HNO2+NaF,
由此可判断下列叙述不正确的是
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 | |
| ① | 取少量上述漂白粉于试管中,加入适量1mol/L盐酸溶解后,再将产生的气体导入到______中. | (1)若______,则假设______成立. (2)若______,则假设______成立. |
| ② | ______ | ______ |
| ③ | ______ | ______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com