
| ||
| ||


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氢氧根离子的电子式是 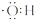 |
B、二氧化碳分子的比例模型是  |
| C、芳香烃的组成通式是CnH2n-6(n≥6) |
D、12C和14C的原子结构示意图均可表示为  |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O的摩尔质量是18 |
| B、等质量的O2和O3中所含的氧原子数相同 |
| C、常温下,22.4LNO2中所含的氧原子数为2NA |
| D、4gNaOH溶解于500mL水中,所得溶液的物质的量浓度为0.2mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸酸化的淀粉KI溶液在空气中变成蓝色:4I-+O2+2H2O═2I2+4OH- | ||||
| B、钢铁发生吸氧腐蚀时,正极的电极反应式:O2+4e-+2H2O═4OH- | ||||
C、氨气催化氧化生产硝酸的主要反应:4NH3+7O2
| ||||
| D、向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+2H2O═H2SiO3+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量的铁粉与氯气反应生成FeCl3 |
| B、少量SO2通入Ca(ClO)2溶液生成CaSO3沉淀 |
| C、氯气能使润湿的淀粉碘化钾试纸变蓝 |
| D、次氯酸钙比次氯酸稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(M+)>c(A-)>c(OH-)>c(H+) |
| B、c(HA)+c(H+)=c(OH-) |
| C、c(M+)>c(A-)>c(H+)>c(OH-) |
| D、c(M+)=c(A-)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com