
 ,
, ;
;
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验事实 | 结论 | |
| A | 苯酚和水的浊液中,加碳酸钠溶液,溶液变澄清 | 苯酚的酸性比碳酸强 |
| B | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 | 随溶液pH减小,“84”消毒液的氧化能力增强 |
| C | 铜放入稀硫酸中,无明显现象,再加入硝酸钠固体,溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D | 向2mL 0.1mol/L的硝酸银溶液中加入1mL0.1mol/L NaCl溶液,出现白色沉淀,再加入几滴0.1mol/L Na2S溶液,有黑色沉淀生成 | 氯化银的溶解度大于硫化银 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 标准状况下,向100mLNaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液显碱性(反应前后溶液的体积变化忽略不计).在溶液M中逐滴缓慢滴加1mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
标准状况下,向100mLNaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液显碱性(反应前后溶液的体积变化忽略不计).在溶液M中逐滴缓慢滴加1mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:| V(A)的取值 | V(A)=0 | 0<V(A)<150 | V(A)=150 | 150<V(A)<300 |
| 溶质的成分 | ① | ② | ③ | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
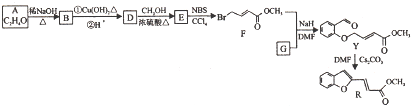
 互为同系物.
互为同系物.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子还原性:Cl->Br- |
| B、气态氢化物的稳定性:H2S>H2Se |
| C、原子半径:Cl>Br>Se |
| D、酸性:H2SeO4>HBrO4>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子、C原子的I,能层中,都有两个未成对的电子,C、D同主族.E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息回答:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子、C原子的I,能层中,都有两个未成对的电子,C、D同主族.E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息回答:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com