
����Ŀ��A��H�ֱ��ʾ��ѧ��ѧ�г�����ij�����ʣ�����֮����ת����ϵ����ͼ��ʾ(���ַ�Ӧ�������δ�г�)����֪��C��D��E��F��G���������о�����ͬһ��Ԫ�أ�AΪ����ɫ���廯���GΪ���ɫ���塣

(1)д����ѧʽ��A��________________��C��________________��F��________________��
(2)д����Ӧ�Ļ�ѧ����ʽ��
��_____________________________________________________________��
��_____________________________________________________________��
(3)д�����ӷ���ʽ��
��_____________________________________________________________��
��_____________________________________________________________��
(4)����24 g B��Ҫת��________mol���ӡ�
���𰸡�Na2O2Fe3O4Fe(OH)22O2��3Fe![]() Fe3O44Fe(OH)2��O2��2H2O===4Fe(OH)3Fe3O4��8H��===Fe2����2Fe3����4H2OFe3����3OH��===Fe(OH)3��1.5
Fe3O44Fe(OH)2��O2��2H2O===4Fe(OH)3Fe3O4��8H��===Fe2����2Fe3����4H2OFe3����3OH��===Fe(OH)3��1.5
��������
C��D��E��F��G�о�����ͬһ��Ԫ�أ�GΪ���ɫ���壬��D��OH-��Ӧ����F��F�ڿ����з������ɵ�G�����ж�GΪFe(OH)3��FΪFe(OH)2��D�Ǻ����������ӵĿ������Ρ�AΪ����ɫ���廯���AΪNa2O2��BΪO2��HΪNaOH��H��E��Ӧ����G����E�Ǻ��������ӵĿ������Ρ�Cת��ΪD��E��Bת��ΪC����C��������������D������FeCl2��E������FeCl3���ݴ˽��
�������Ϸ�����֪AΪNa2O2��BΪO2��C��������������D������FeCl2��E������FeCl3��FΪFe(OH)2��GΪFe(OH)3��HΪNaOH����
��1��A��C��F�Ļ�ѧʽ�ֱ���Na2O2��Fe3O4��Fe(OH)2��
��2����Ӧ�ڵķ���ʽΪ2O2��3Fe![]() Fe3O4����Ӧ�ķ���ʽΪ4Fe(OH)2��O2��2H2O��4Fe(OH)3��
Fe3O4����Ӧ�ķ���ʽΪ4Fe(OH)2��O2��2H2O��4Fe(OH)3��
��3����Ӧ�۵����ӷ���ʽΪFe3O4��8H����Fe2����2Fe3����4H2O����Ӧ�ݵ����ӷ���ʽΪFe3����3OH����Fe(OH)3����
��4������B�ķ�ӦΪ2Na2O2+2H2O��4NaOH+O2����������������Ϊ-1�ۣ���������Ϊ0�ۣ���ÿ����1molO2ת��2mol���ӣ�������24g���������������ʵ�����24g��32g/mol��0.75mol����ת�Ƶ��ӵ����ʵ�����0.75mol��2��1.5mol��


 ��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0��lmol/L NaOH��Һ��ͨ�������CO2����Һ�д��ڵ���Ҫ�����ǣ� ��
A.Na+��CO32��
B.Na+��HCO3��
C.CO32����HCO3��
D.Na+��OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2O2��һ�ֳ����Լ�����ʵ���ҡ���ҵ�������й㷺��;

��.ʵ������H2O2������������ֽ������ܶ�������Ӱ�졣ʵ����70��ʱ��ͬ������H2O2Ũ����ʱ��ı仯����ұ�����ͼ��ʾ��
��1������˵����ȷ���ǣ�________������ĸ��ţ�
A��ͼ�ױ���������������ͬʱ��H2O2Ũ��ԽС����ֽ�����Խ��
B��ͼ�ұ���������������ͬʱ����Һ����Խ����H2O2�ֽ�����Խ��
C��ͼ������������Mn 2+����ʱ����Һ����Խǿ��H2O2�ֽ�����Խ��
D��ͼ����ͼ��������������Һ�У�Mn2+��H2O2�ֽ����ʵ�Ӱ���
��2������Mn2+�ڷ�Ӧ�У��ı���____________________(����ĸ���)
A����Ӧ���� B����Ӧ��C����Ӧ�ʱ� D����Ӧ·��
E.��Ӧ��� F.����Ӱٷ���
��. H2O2�ڹ�ҵ����ΪFenton����Ҫ�Լ��������ڴ������ѽ����л���Ĺ�ҵ��ˮ���ڵ��ں�pH����Һ������ԣ���Fe2+Ũ�ȵķ�ˮ�м���H2O2�����������ǻ����ɻ�������������Ⱦ������ø÷��������л���Ⱦ��p-CP��̽���й����ضԸý��ⷴӦ���ʵ�Ӱ�졣
��ʵ����ơ�����p-CP�ij�ʼŨ����ͬ���㶨ʵ���¶���298K��313K������ʵ���������±�����������¶Ա����飬����ʵ��������ʱ��-p-CPŨ��ͼ���¡�

��3�������Ե��ǻ����ɻ��ĵ���ʽΪ��______________
��4�����������ʵ����Ʊ�(���в�Ҫ���ո�)��
ʵ�� ��� | ʵ��Ŀ�� | T/K | pH | c/10-3mol��L-1 | |
H2O2 | Fe2+ | ||||
�� | Ϊ����ʵ�����ο� | 298 | 3 | 6.0 | 0.30 |
�� | ̽���¶ȶԽ��ⷴӦ���ʵ�Ӱ�� | _________ | ______ | _______ | _________ |
�� | __________________ | <>298 | 10 | 6.0 | 0.30 |
��5�����������ͼʵ�������ߣ����㽵�ⷴӦ��50��150s�ڵķ�Ӧ���ʣ�v(p-CP)=_____________
��6��ʵ��ʱ���ڲ�ͬʱ��ӷ�Ӧ����ȡ������ʹ��ȡ��Ʒ�еķ�Ӧ����ֹͣ����������ʵ����������һ��Ѹ��ֹͣ��Ӧ�ķ�����__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������������ȷ����
A. 0.1mol/L������Һ�к��д�����ӵ���ĿΪ0.1NA
B. 25��ʱ��1LpH=12��Na2CO3��Һ�к���Na+����ĿΪ0.2NA
C. �����£�20LpH=12��Na2CO3��Һ�к���OH-��ĿΪ0.2NA
D. ij�ܱ�����ʢ��0.1molN2��0.3molH2����һ�������³�ַ�Ӧ,ת�Ƶ�����ĿΪ0.6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�һ�����ܱ����з������淴Ӧ��A(g)+2B(g) ![]() 2C(g)����H=+Q��Q>0���������仯ʱ��Ӱ��ƽ���ƶ��Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
2C(g)����H=+Q��Q>0���������仯ʱ��Ӱ��ƽ���ƶ��Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
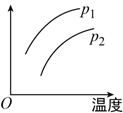
A. p1<p2��������ָA����������
B. p1>p2��������ָC����������
C. p1>p2��������ָ��������ƽ��Ħ������
D. p1>p2��������ָA��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ���г�������ζ�ľ綾����,����������������о�����ҪӦ�á�
��1����ҵ�ϲ��ø����ȷֽ�H2S�ķ�����ȡH2,��Ĥ��Ӧ���з����H2,�����ķ�ӦΪ2H2S(g)![]() 2H2(g)+S2(g)��H
2H2(g)+S2(g)��H
��֪����H2S(g)![]() H2(8)+S(g)��H1
H2(8)+S(g)��H1
��2S(g)![]() S2(g)��H2
S2(g)��H2
����H=________(�ú���H1����H2��ʽ�ӱ�ʾ)��
��2�����ݻ�2 L�ĺ����ܱ�������,���Ʋ�ͬ�¶Ƚ���H2S�ֽ⣺2H2S(g)![]() 2H2(g)+S2(g)��H2S����ʼ���ʵ�����Ϊ1mol,ʵ������в��H2S��ת������ͼ1��ʾ������a��ʾH2S��ƽ��ת�������¶ȵĹ�ϵ,����b��ʾ��ͬ�¶��·�Ӧ������ͬʱ��ʱH2S��ת���ʡ�
2H2(g)+S2(g)��H2S����ʼ���ʵ�����Ϊ1mol,ʵ������в��H2S��ת������ͼ1��ʾ������a��ʾH2S��ƽ��ת�������¶ȵĹ�ϵ,����b��ʾ��ͬ�¶��·�Ӧ������ͬʱ��ʱH2S��ת���ʡ�

����Ӧ2H2S (g)![]() 2H2(g)+S2(g)�Ƿ��Ȼ������ȣ��жϲ�˵����________��
2H2(g)+S2(g)�Ƿ��Ȼ������ȣ��жϲ�˵����________��
������H2S�ֽ��¶ȵ�����,����b������a����,��ԭ����________ ��
����985��ʱ,�÷�Ӧ����5 s�ﵽƽ��,��÷�Ӧ��ƽ�ⳣ��Ϊ________����ͼ2�л���985��ʱ,0��6s ��ϵ��S2(g)Ũ����ʱ��ı仯���ߡ�___________________


��3����ҵ�ϳ���NaOH��Һ����H2S����,���պ�������Һ���е��(װ����ͼ3��ʾ),��������������Sx2-,д������Sx2-���ӵĵ缫��Ӧʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ��ѧ��˵������ȷ���ǣ� ��
A.��ѧ�о���������صĻ�����Ⱦ���������������ڻ�ѧ������
B.��ѧ�о�����ҪĿ������ʶ����
C.��ѧ�ҿ����������Ȼ���в����ڵ�����
D.������ѧ���Ž��з������ԭ��ѧ˵��Ϊ������ѧ�ķ�չ�춨�˻���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�ֹ�������Ŵ�����������Ǯ�Ҽ�װ�������ִ��ڵ�غ��������ĵ��������й㷺Ӧ�á��ش��������⡣
��1���ô���������������ڣ�ʧȥ����ɫ�Ĺ���ԭ����________��
��2����֪Ksp(AgCl)=1.8��10-10����VmL0.018mol/L��AgNO3��Һ��VmL0.020mol/L�����ᣬ��Ϻ���Һ�е�Ag+��Ũ��Ϊ______mol/L��pHΪ________��
��3��AgNO3��Һ�����ֽ⣬����Ag�ͺ���ɫ��������ʣ�����շֽ�Ļ�ѧ����ʽΪ________��
��4����ͼ��ʾԭ��������ķ�ӦʽΪ_________��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com