
【题目】向0.lmol/L NaOH溶液中通入过量的CO2后,溶液中存在的主要离子是( )
A.Na+、CO32﹣
B.Na+、HCO3﹣
C.CO32﹣、HCO3﹣
D.Na+、OH﹣
科目:高中化学 来源: 题型:
【题目】某同学用NaHCO3和KHCO3组成的混合物进实验,测得的实验数据如下表所示(盐酸的物质的量浓度相同):(计算结果保留3位有效数字)
实验编号 | ① | ② | ③ |
盐酸体积(mL) | 50 | 50 | 50 |
混合物的质量(g) | 9.2 | 15.7 | 27.6 |
标准状况下CO2的体积(L) | 2.24 | 3.36 | 3.36 |
回答下列问题:
(1)由实验______________(填实验编号)可判断盐酸完全反应,理由是_____________。
(2)盐酸的物质的量浓度为__________________。
(3)产生标准状况下3.36LCO2所需固体的质量为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氢键的下列说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在单个水分子、水蒸气、液态水、冰中都存在氢键
C. 分子间能形成氢键使物质的熔沸点升高
D. HF的热稳定性很强,是因为其分子间能形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成(CH3)4NOH,其工作原理如下图所示(a、b为石墨电板,c、d、e为离子交换膜),下列说法正确的是( )
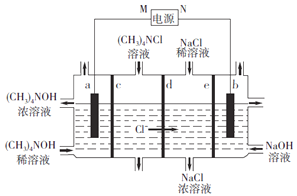
A. M为正极 B. c、e均为阳离子交换膜
C. b极电极反应式:2H2O-4e-=O2↑+4H+ D. 制备1mol(CH3)4NOH,a、b两极共产生0.5mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( ) 
A. 铜棒的质量
B. 锌棒的质量
C. 氢离子的浓度
D. 硫酸根离子的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)常用作半导体掺杂剂及光导纤维原料。某化学小组用PCl3氧化法制备POCl3的装置如下图所示。已知:POCl3的沸点是105.1℃,PCl3 的沸点是65.5℃;二者遇潮湿空气都易生成酸雾。

(1)仪器a的名称为_______________。
(2)装置A是氧气的发生装置,试写出A中发生反应的化学方程式:___________________。
(3)装置B的作用是______________________________________________________________。
(4)装置C中反应温度应控制在60~65℃,原因是_____________________________________。
(5)通过佛尔哈德法可以测定POCl3产品中氯元素的质量分数,实验步骤如下:
Ⅰ.取1.5000g 产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸调至酸性。
Ⅱ.向锥形瓶中加入3.2000mol·L-1的AgNO3溶液10.00mL,使Cl-完全沉淀。
Ⅲ.向其中加入2.00mL硝基苯,用力摇动,使沉淀表面被硝基苯覆盖。
Ⅳ.加入指示剂,用0.2000mol·L-1NH4SCN标准溶液滴定过量Ag+至终点,消耗10.00mLNH4SCN溶液。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12。
①滴定选用的指示剂是________(填代号)。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中加入硝基苯的目的是_____________________________,若无此操作所测氯元素的质量分数将会________(填“偏大”、“偏小” 或“不变”)。
③产品中氯元素的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往锅炉注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,再用盐酸去除,下列叙述正确的是
A. 温度升高Na2CO3溶液的Kw和c(H+)均会增大
B. CaSO4能转化为CaCO3,说明Ksp(CaCO3)>Ksp(CaSO4)
C. CaCO3溶解于盐酸而CaSO4不溶,是因为硫酸酸性强于盐酸
D. 沉淀转化的离子方程式为CO32(aq)+CaSO4(s)![]() CaCO3(s)+SO42(aq)
CaCO3(s)+SO42(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H分别表示中学化学中常见的某种物质,它们之间的相互转化关系如下图所示(部分反应物、生成物未列出)。已知:C、D、E、F、G五种物质中均含有同一种元素;A为淡黄色固体化合物;G为红褐色固体。

(1)写出化学式:A:________________;C:________________;F:________________。
(2)写出反应的化学方程式:
②_____________________________________________________________。
⑥_____________________________________________________________。
(3)写出离子方程式:
③_____________________________________________________________。
⑤_____________________________________________________________。
(4)生成24 g B需要转移________mol电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com