
| A. | 洗涤,2次 | B. | 过滤,2次 | C. | 分液,3次 | D. | 过滤,3次 |
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③⑧ | B. | ②③⑥⑦ | C. | ①③⑥⑦ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
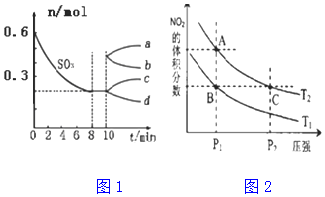
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
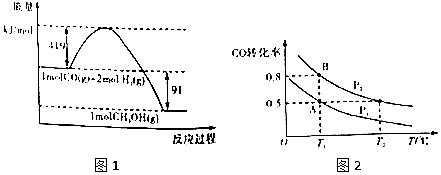
| 化学键 | H-H | H-O | O=O |
| 键能kj/mol | 436 | x | 496 |
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
| 平衡时容器体积 | V(甲) | V(乙) | V(丙) |
| 反应的平衡常数K | K(甲) | K(乙) | K(丙) |
| 平衡时CH3OH的浓度/mol•L-1 | C(甲) | C(乙) | C(丙) |
| 平衡时CH3OH的反应速率/mol•L-1•min-1 | v(甲) | v(乙) | v(丙) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
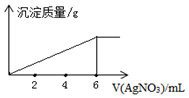
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取35.20g NaOH | |
| B. | 用10mL量筒量取8.50mL浓盐酸配一定物质的量浓度溶液 | |
| C. | 用25ml滴定管量取15.80ml浓溶液配一定物质的量浓度溶液 | |
| D. | 用pH试纸测得溶液pH为4.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该反应条件下,Mg的还原性强于C的还原性 | |
| B. | Mg、MgO中镁元素微粒的半径:r(Mg2+)<r(Mg) | |
| C. | 元素C 在自然界中既有游离态又有化合态 | |
| D. | 该反应中化学能全部转化为热能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com