
| A. | MnO4-→Mn2+ | B. | H2O2→H2O | C. | H2→H2O | D. | Zn→Zn2+ |
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
 氰、硫、碳的氧化物有多种,其中S02和N0x都是大气污染物,对它们的研究有助于空气的净化.
氰、硫、碳的氧化物有多种,其中S02和N0x都是大气污染物,对它们的研究有助于空气的净化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、CO32-、HCO3-、SO42- |
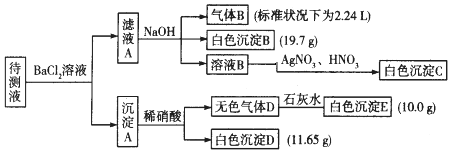
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3-->Al(OH)3 | B. | Cu-->CuCl2 | C. | Fe-->FeCl2 | D. | Na-->NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗涤,2次 | B. | 过滤,2次 | C. | 分液,3次 | D. | 过滤,3次 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com