
 氰、硫、碳的氧化物有多种,其中S02和N0x都是大气污染物,对它们的研究有助于空气的净化.
氰、硫、碳的氧化物有多种,其中S02和N0x都是大气污染物,对它们的研究有助于空气的净化.分析 (1)已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),
②2NO(g)+Cl2(g)?2ClNO(g),
根据盖斯定律①×2-②可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数为①的平衡常数平方与②的商;
(2)测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,根据方程式知,参加反应的n(NO)=△n(ClNO)=0.15mol,NO的转化率=$\frac{n(NO)(反应)}{反应初始n(NO)}$×100%;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动;
(3)①根据先拐先平数值大知,T2>T1,升高温度NO含量增大,平衡逆向移动,升高温度平衡向吸热方向移动;
②若催化剂的表面积S1>S2,在T1、S2条件下达到的平衡和T1、S1条件下达到的平衡一样,但是反应速率减慢了;
(4)常温下某NaNO2和HNO2混合溶液的pH为5,该溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L=10-9 mol/L,NO2-的水解常数=$\frac{c(HN{O}_{2}).c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$,据此计算混合溶液中c(NO2-)和c(HNO2)的比值;
(5)如果钡离子与亚硫酸根离子浓度积大于溶度积时就产生沉淀,否则不产生沉淀.
解答 解:(1)2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1 △H<0 (I)
2NO(g)+Cl2(g)?2ClNO(g) K2 △H<0 (II)
根据盖斯定律,Ⅰ×2-Ⅱ可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数K=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$,
故答案为:$\frac{{{K}_{1}}^{2}}{{K}_{2}}$;
(2)测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,根据方程式知,参加反应的n(NO)=△n(ClNO)=0.15mol,NO的转化率=$\frac{n(NO)(反应)}{反应初始n(NO)}$×100%=$\frac{0.15mol}{0.2mol}$×100%=75%;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO的转化率增大,则平衡时NO的转化率a2>a1,
故答案为:75%;>;
(3)①根据先拐先平数值大知,T2>T1,升高温度NO含量增大,平衡逆向移动,升高温度平衡向吸热方向移动,根据图知,正反应是放热反应,则△H<0,
故答案为:<;
②若催化剂的表面积S1>S2,在T1、S2条件下达到的平衡和T1、S1条件下达到的平衡一样,但是反应速率减慢了,c(NO)在T1、S2条件下达到平衡过程中的变化曲线如右图所示: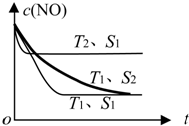
故答案为: ;
;
(4)常温下某NaNO2和HNO2混合溶液的pH为5,该溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L=10-9 mol/L,NO2-的水解常数=$\frac{c(HN{O}_{2}).c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$,混合溶液中c(NO2-)和c(HNO2)=10-9:2×10-11=50,
故答案为:50;
(5)c(Ba 2+ ).(SO32- )=6.3×10-8×0.1=6.3×10-9<Ksp=5.48×10-7,所以不能产生沉淀,
故答案为:不能;c(Ba 2+ ).(SO32- )=6.3×10-8×0.1=6.3×10-9<Ksp=5.48×10-7,所以不能产生沉淀.
点评 本题考查化学平衡计算、难溶物的溶解平衡、盐类水解等知识点,综合性较强,侧重考查学生分析、计算能力,明确盐类水解、难溶物的溶解平衡、化学平衡原理等知识点是解本题关键,注意公式的灵活应用,题目难点中等.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:填空题
 (1)在一定条件下N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol
(1)在一定条件下N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 | |
| B. | 加强城市生活污水脱氮除磷处理,遏制水体富营养化 | |
| C. | 将废旧电池深埋,防止其中的重金属离子污染环境 | |
| D. | 大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20℃时,铝的密度为2.7 g/cm3,则1个Al原子的体积为($\frac{10}{{N}_{A}}$)cm3 | |
| B. | 25℃、101KPa下,16 g O2与O3的混合气体中含电子数为8NA | |
| C. | 25℃、101KPa下,11.2L Cl2含有的分子数小于0.5NA | |
| D. | 0℃、101KPa下,等体积的CH4和CCl4中含C原子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com