
| A. | SO2 | B. | Na2O | C. | CO | D. | Na2O2 |
分析 氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素.氧化物可根据构成元素分为:金属氧化物、非金属氧化物;根据能否和酸、碱反应生成盐和水,氧化物又可分为:酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物.能和酸反应生成盐和水,属于碱性氧化物,CaO、CuO是金属氧化物,也是碱性氧化物.
解答 解:CaO、CuO是金属氧化物,也是碱性氧化物.
A、SO2是非金属氧化物,还是酸性氧化物,故A不符合;
B、Na2O是金属氧化物,也是碱性氧化物,故B符合;
C、CO是非金属氧化物,还是不成盐氧化物,故C不符合;
D、Na2O2与酸反应生成盐和水以及氧气,不属于碱性氧化物,故D不符合;
故选B.
点评 本题考查了氧化物的分类问题,注意氧化物根据不同的分类标准有两种分类方法,题目难度不大.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、SO42- | B. | K+、Na+、Cl-、Cr2O42- | ||
| C. | Al3+、K+、AlO2-、Cl- | D. | Fe3+、NO3-、SO42-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 1.0L0.1 mol•L-1 AlCl3溶液中所含的Al3+离子数为0.1NA | |
| C. | 标准状况下,11.2LSO3中含有分子数目为0.5NA | |
| D. | 常温常压下,3.2gO2和O3混合气体中含有的氧原子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解的目的是提高汽油等轻质油的产量和质量 | |
| B. | “神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 | |
| C. | 补血口服液中添加维生素c,作为氧化剂 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入冷水中:Cl2+H2O?Cl-+ClO-+2H+ | |
| B. | 亚硫酸氨溶液与足量氢氧化钠溶液反应 HSO3-+OH-═SO32-+H2O | |
| C. | 氢氧化钠溶液吸收过量的二氧化碳 OH-+CO2═HCO3- | |
| D. | 碳酸镁悬浊液中加醋酸 CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氰、硫、碳的氧化物有多种,其中S02和N0x都是大气污染物,对它们的研究有助于空气的净化.
氰、硫、碳的氧化物有多种,其中S02和N0x都是大气污染物,对它们的研究有助于空气的净化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、CO32-、HCO3-、SO42- |
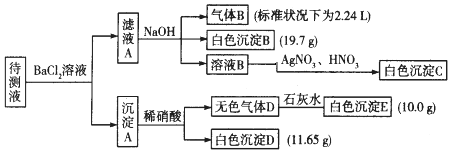
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com