
 (1)在一定条件下N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol
(1)在一定条件下N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol分析 (1)N2和H2完全反应生成1molNH3放热46.0kJ热量,生成2mol氨气放热92KJ,氨气分解为吸热反应,反应的焓变为+92KJ,依据热化学方程式书写得到;
(2)根据盖斯定律来计算化学反应的焓变,结合焓变和系数之间的关系来回答;
(3)根据盖斯定律来计算化学反应的焓变,书写热化学方程式即可;
(4)N4气体转变为N2气体先破坏N4分子N-N键吸收能量,再生成N2分子形成N≡N键放出能量,注意一个N4分子中含有6个N-N键,根据能量的变化写出热化学反应方程式;
(5)电池放电时是原电池,将化学能转化为电能,负极发生氧化反应,电极反应式为:CH4+10 OH--8e-=CO32-+7H2O;
解答 解:(1)N2和H2完全反应生成1molNH3放热46.0kJ热量,生成2mol氨气放热92KJ,氨气分解为吸热反应,反应的焓变为+92KJ,反应的热化学方程式为:2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol;
故答案为:2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol;
(2)①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220.0kJ•mol-1
②H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则丙烷燃烧生成CO2和气态水时的反应为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(g),△H=①+②×4=-2220.0kJ•mol-1+4×44.0kJ•mol-1=2044kJ•mol-1,所以
0.5mol丙烷燃烧生成CO2和气态水时释放的热量为1022kJ,故答案为:1022kJ;
(3)①TiO2 (s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
依据盖斯定律①+②得到:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ•mol-1;
故答案为:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ•mol-1;
(4)根据原子守恒知,一个N4分子生成2个N2分子,一个N4分子中含有6个N-N键,破坏1molN4分子中含有6molN-N键需要吸收193kJ/mol×6mol=1158KJ能量;
生成2molN≡N键放出941kJ/mol×2mol=1882KJ能量,所以该反应放出1884KJ-1158KJ=724KJ能量,所以热化学反应方程式为N4(g)=2N2(g)△H=-724KJ/mol,
故答案为:724;
(5)电池放电时是原电池,将化学能转化为电能,负极发生氧化反应,电极反应式为:CH4+10OH--8e-=CO32-+7H2O,故答案为:化学;电;CH4+10OH--8e-=CO32-+7H2O.
点评 本题考查了盖斯定律及原电池原理,难点是电极反应式的书写,要根据电解质溶液的酸碱性书写,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | lgH2 和 8gO2 | |
| B. | 150℃、1.01×105Pa 时,18LH2O和 18LCO2 | |
| C. | 0.1 molHCl和2.24LHe | |
| D. | 标准状况下,2.24LCCl4和6.02×1022个CO分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、SO42- | B. | K+、Na+、Cl-、Cr2O42- | ||
| C. | Al3+、K+、AlO2-、Cl- | D. | Fe3+、NO3-、SO42-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| AgNO3 | Ba(NO3)2 | AgCl | BaC12 | |
| H2O (液) | 170g | 9.2g | 1.5×10-4g | 33.3g |
| NH3(液) | 86g | 97.2g | 0.8g | 0g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
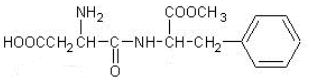
| A. | 分子式为C14H19N2O5 | B. | 既能与酸反应又能与碱反应 | ||
| C. | 不能发生水解反应 | D. | 1mol该物质最多可与2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定时可以用pH计或石蕊试液准则判断滴定终点 | |
| B. | 滴定前平视,滴定后俯视酸式滴定管,得出的滴定结果偏大 | |
| C. | 滴定前要用待测烧碱溶液洗涤锥形瓶 | |
| D. | 滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色变化,直到滴定终点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 1.0L0.1 mol•L-1 AlCl3溶液中所含的Al3+离子数为0.1NA | |
| C. | 标准状况下,11.2LSO3中含有分子数目为0.5NA | |
| D. | 常温常压下,3.2gO2和O3混合气体中含有的氧原子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解的目的是提高汽油等轻质油的产量和质量 | |
| B. | “神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 | |
| C. | 补血口服液中添加维生素c,作为氧化剂 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氰、硫、碳的氧化物有多种,其中S02和N0x都是大气污染物,对它们的研究有助于空气的净化.
氰、硫、碳的氧化物有多种,其中S02和N0x都是大气污染物,对它们的研究有助于空气的净化.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com