
����Ŀ����Ԫ�صĻ������ж��֡�
�ش��������⣺
��1��SiH4�ķе��CH4�ߣ�ԭ����____________________________________��
��2������̼ͬ���壬Ҳ��ϵ���⻯�������������������϶�Զ���������ࡣ�����±��� ���м������ݣ���Ҫ�������ܵ�ԭ��___________________________________��
��ѧ�� | C��C | C��H | Si��Si | Si��H |
����/(kJ��mol-1) | 356 | 413 | 226 | 318 |
�����裨Si3N4����һ����Ҫ���մɲ��ϣ�����ʯӢ�뽹̿��800��ĵ��������ºϳɣ�
3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
��3�����������Ӧ�е���ת�Ƶ���Ŀ�ͷ���____________��
��4���÷�Ӧ��ƽ�ⳣ������ʽK=____________����֪ƽ�ⳣ����K(800��)>K(850��)����Ӧ��_________��Ӧ������ȡ������ȡ�����
��5����д��������߶�������ת���ʵĴ�ʩ_________________��_________________��
��6��һ���¶��£���2L�ܱ������ڣ�����һ�����ķ�Ӧ�5����ʱ�ﵽƽ�⣬�������������������0.4mol����CO��ʾ�÷�Ӧʱ���ڵķ�Ӧ����Ϊ_________________��
���𰸡� �����ǽṹ���Ƶķ��Ӿ��壬SiH4�ķ�������CH4�ķ��������»��������Էе��CH4�ߡ� Si��Si�ļ��ܱ�C��CС��Si��H�ļ���Ҳ��C��HС���������ѣ����Թ����������������������١� 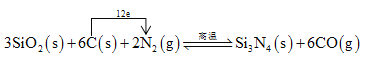
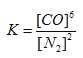 ���� ���� ��Сѹǿ 0.06mol/(L��min)
���� ���� ��Сѹǿ 0.06mol/(L��min)
�����������������(1)���Ӿ���ķе�����Է�����������������ߣ�(2)����Խ������Խ�ȶ���(3) 3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g) ��Ӧ�е�Ԫ�صõ��ӻ��ϼ۽���̼Ԫ��ʧ���ӻ��ϼ����ߣ�(4)���ݻ�ѧ����ʽ��дƽ�ⳣ���������¶�ƽ�ⳣ����С��˵��ƽ�������ƶ���(5)ƽ�������ƶ���ʹ��������ת��������(6)���ò�������������CO�����ʵ�����������
Si3N4(s)+6CO(g) ��Ӧ�е�Ԫ�صõ��ӻ��ϼ۽���̼Ԫ��ʧ���ӻ��ϼ����ߣ�(4)���ݻ�ѧ����ʽ��дƽ�ⳣ���������¶�ƽ�ⳣ����С��˵��ƽ�������ƶ���(5)ƽ�������ƶ���ʹ��������ת��������(6)���ò�������������CO�����ʵ�����������![]() �������ʡ�
�������ʡ�
������(1)���Ӿ���ķе�����Է�����������������ߣ������ǽṹ���Ƶķ��Ӿ��壬SiH4�ķ�������CH4�ķ��������»��������Էе��CH4�ߣ�(2)����Խ������Խ�ȶ���Si��Si�ļ��ܱ�C��CС��Si��H�ļ���Ҳ��C��HС���������ѣ����Թ����������������������٣�(3) 3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g) ��Ӧ�е�Ԫ�صõ��ӻ��ϼ۽���̼Ԫ��ʧ���ӻ��ϼ����ߣ����Ե���ת�Ƶķ���� ��ĿΪ
Si3N4(s)+6CO(g) ��Ӧ�е�Ԫ�صõ��ӻ��ϼ۽���̼Ԫ��ʧ���ӻ��ϼ����ߣ����Ե���ת�Ƶķ���� ��ĿΪ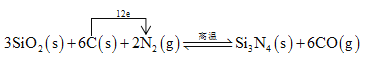 ��(4)���岻��д��ƽ�ⳣ������ʽ�����ݻ�ѧ����ʽ��ƽ�ⳣ��
��(4)���岻��д��ƽ�ⳣ������ʽ�����ݻ�ѧ����ʽ��ƽ�ⳣ��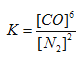 �������¶�ƽ�ⳣ����С��˵��ƽ�������ƶ������Ը÷�Ӧ���ȣ�(5) ���� ���Сѹǿ��ʹƽ�������ƶ�����������ת��������(6)��5����CO���ʵ�������xmol
�������¶�ƽ�ⳣ����С��˵��ƽ�������ƶ������Ը÷�Ӧ���ȣ�(5) ���� ���Сѹǿ��ʹƽ�������ƶ�����������ת��������(6)��5����CO���ʵ�������xmol
3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g) �������ʵ�������
Si3N4(s)+6CO(g) �������ʵ�������
6 6-2
x 0.4
![]() �� x=0.6��
�� x=0.6�� ![]() =
=![]() 0.06mol/(L��min)��
0.06mol/(L��min)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���������ȷ���ǣ� ��
A. 2���һ�����B. 3.3����������
C. 2��2��������D. �䩁���ױ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��̽�����ؿ�������������ԭ������֤Cl2�����ʣ����ʵ�����£��г�װ����ȥ����ش��������⣺
I. Cl2���Ʊ���
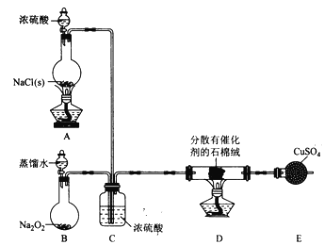
��1��װ��B�з�����Ӧ�Ļ�ѧ����ʽΪ____________________��
��2��װ��C�����ó������������_________________��
��3��װ�� E��ʢ��CuSO4����������Ϊ_______________����Ӧ��ʼ������ͭ��������װ��D�з�����Ӧ�Ļ�ѧ����ʽΪ_____________________��
II. Cl2���ʵ���֤��
��С����ʵ��I���Ƶõ�Cl2����ͼ��ʾװ�ã������ظ�ʹ�ã�������֤���﴿����Cl2��Ư���ԡ�ʪ���Cl2��Ư���ԡ�Cl�ķǽ�����ǿ��S
�������ϣ�
��PdCl2��Һ����COʱ�����ɽ������ʺ������������廯���
������CO2������ʵ�飻
�۸�ʵ�������£�C��Cl2����Ӧ��
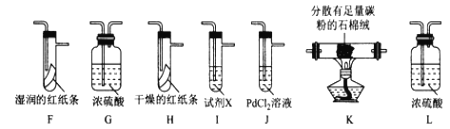
��4�������������ҵķ���װ�����ӵĺ���˳��ΪE��__��__��__��__��__��__��__��β������____________����װ����ĸ,��
��5���Լ�X������Ϊ____________��
��6��װ��J�з�����Ӧ�Ļ�ѧ����ʽΪ_________________��
��7�����ʵ��֤�����������Cl2�в���HC1��_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����д���״���CH3OH���Ϳ�����ɵ�ȼ�ϵ�ص��������ҺΪKOHʱ�������缫��ӦʽΪ__________��������ӦʽΪ__________��
��2��NaCl�ۻ�ʱ���ƻ�����_____________���ƾ�����ˮʱ�ƻ�����___________��������Ӽ��������Լ������Ǽ��Լ������Ӽ�������������
��3��д���������ʵĵ���ʽ��
CO2_______________ Na3N _______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�ֲ����ҹ�����ɽ��С�˰���ȵأ����ϻ���Ҫ�ֲ����ҹ������������ϵ�������������ѧ����֪ʶ�жϣ�������֮������Ӧ�������滷�����뻪�ϻ���ȣ������������ʺ�����ռ�������Ըߣ��� ��
A. ֬�� B. ��ԭ C. ������ D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʹƷ����ɫ��˵�������������
A����ԭ�� B�������� C������ D��Ư����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����Ʒ�����������ε����ʽ���̽����
�ش��������⣺
�������Ʊ�
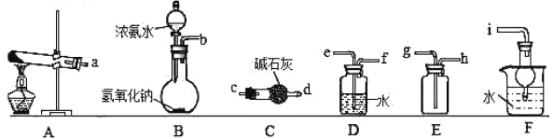
��1������Aװ���Ʊ�������д����Ӧ�Ļ�ѧ����ʽ_______________�����ռ�һƿ����İ�����ѡ����ͼ�е�װ�ã����ظ�ʹ�ã���������˳��Ϊ��a��___________��������������Сд��ĸ��ʾ����
��2����װ��B����Ũ��ˮ���������ƹ����ϣ�Ҳ���Ƶð���������÷����Ʊ�������ԭ ��________________________��
����ͼװ�ý��а���������ʵ�飨����1������2ʵ��ǰ�رգ���G��H�������������������
��3���ȴ�����I��Hƿ��������________________��ԭ����________________��һ��ʱ��ر�����1���ٴ������2��Hƿ��������_________��
�����ʵ�飬̽��ijһ���ض�һ�����ʵ���Ũ��NH4Clˮ��̶ȵ�Ӱ�졣
��ѡ�Լ���������NH4Cl���塢����ˮ���ձ�����ͷ�ιܡ���������ҩ�ס�������ƽ��pH�ơ��¶ȼơ�����ˮԡ�ۣ��ɿ����¶ȣ�
��4����������������ȱ��һ����Ҫ�IJ�����������������_______________��
��5�����������������Լ����������Ʋ�ʵ��Ŀ�ģ�̽��_______��NH4Clˮ��̶ȵ�Ӱ�졣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ����
A. pH=a�İ�ˮ��Һ��ϡ��10������pH=b����b<a-1
B. pH��ͬ�Ģ�CH3COONa ��NaHCO3 ��NaClO������Һ��c(Na+)����<��<��
C. ij�¶�Ksp(Ag2S)=6��10-50�� Ksp(AgCl)=2��10-6�� �� 2AgCl(s)+S2-(aq)![]() Ag2S(s)+2Cl-(aq)��ƽ�ⳣ��ԼΪ6.7��1037
Ag2S(s)+2Cl-(aq)��ƽ�ⳣ��ԼΪ6.7��1037
D. һ��Ũ�ȵ� NaHS ��Һ�У�c(Na+)+c(OH-)==c(H+)+c(HS-)+2c(H2S)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2.3g����M�Ļ���������������ᷴӦ������0.2g��������M������
A. þ B. �� C. ̼ D. ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com