
【题目】某小组探究“地康法制氯气”的原理并验证Cl2的性质,设计实验如下(夹持装置略去)请回答下列问题:
I. Cl2的制备。
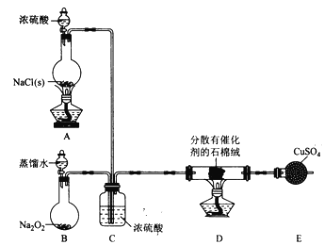
(1)装置B中发生反应的化学方程式为____________________。
(2)装置C的作用除干燥气体外还有_________________。
(3)装置 E中盛放CuSO4的仪器名称为_______________;反应开始后,硫酸铜变蓝,则装置D中发生反应的化学方程式为_____________________。
II. Cl2性质的验证。
该小组用实验I中制得的Cl2和如图所示装置(不能重复使用)依次验证干燥纯净的Cl2无漂白性、湿润的Cl2有漂白性、Cl的非金属性强于S
査阅资料:
①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物;
②少量CO2不干扰实验;
③该实验条件下,C与Cl2不反应。
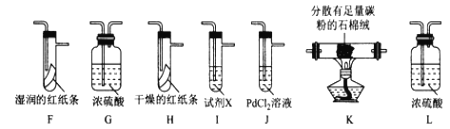
(4)按气流从左到右的方向,装置连接的合理顺序为E→__→__→__→__→__→__→__→尾气处理____________(填装置字母,)
(5)试剂X的名称为____________。
(6)装置J中发生反应的化学方程式为_________________。
(7)设计实验证明经净化后的Cl2中不含HC1:_______________
【答案】 2Na2O2+2H2O=4NaOH+O2 控制气体的流速和比例、使气体混合均匀 (球形)干燥管 4HCl+O2![]() 2H2O+ 2Cl2 G(或L)KJL(或G )HFI 硫化钠溶液(其他合理答案也给分) PdCl2+CO+H2O=Pd+CO2+2HCl 将净化后的混合气体通入足量CCl4,再通过湿润的蓝色石蕊试纸,试纸不变红(或通入AgNO3溶液,无白色沉淀生成),则证明净化后的Cl2中不含HCl
2H2O+ 2Cl2 G(或L)KJL(或G )HFI 硫化钠溶液(其他合理答案也给分) PdCl2+CO+H2O=Pd+CO2+2HCl 将净化后的混合气体通入足量CCl4,再通过湿润的蓝色石蕊试纸,试纸不变红(或通入AgNO3溶液,无白色沉淀生成),则证明净化后的Cl2中不含HCl
【解析】I.由题意,A为制取HCl装置;B为制取O2装置;C处浓硫酸吸水干燥,还可以通过导管口气泡的情况,调节HCl和O2的流速,使两种气体按一定比例充分混合,在D中反应制取氯气;E为检验有水生成的装置。
(1)B中过氧化钠和水反应制取氧气,反应化学方程式为:2Na2O2+2H2O=4NaOH+O2↑。
(2)装置C除了干燥气体外,还可以根据导管口气泡的情况,调节HCl和O2的流速,使两种气体按一定比例混合均匀。
(3)E为球形干燥管,反应开始后,E中硫酸铜变蓝,则装置D中有水生成,由题意,反应化学方程式为:4HCl+O2![]() 2H2O+2Cl2。
2H2O+2Cl2。
II.该小组用实验I中制得的Cl2和如图所示装置(不能重复使用)验证干燥纯净的Cl2的性质,应除去水蒸气和O2,结合所给三条信息,K装置发生2C+O2![]() 2CO,从而除去O2;I中应盛有硫化钠或硫化钾溶液,通过反应:Cl2+Na2S=2NaCl+S↓,验证Cl的非金属性强于S;J为吸收CO的装置。
2CO,从而除去O2;I中应盛有硫化钠或硫化钾溶液,通过反应:Cl2+Na2S=2NaCl+S↓,验证Cl的非金属性强于S;J为吸收CO的装置。
(4)由上述分析,先除去水蒸气和氧气,再捕获CO,然后检验漂白性,最后检验非金属性强弱。按气流从左到右的方向,装置连接的合理顺序为E→G(L)→K→J→L(G)→H→F→I→尾气处理。
(5)I中应盛有硫化钠或硫化钾溶液,通过反应:Cl2+Na2S=2NaC1+S↓,验证Cl的非金属性强于S。
(6)由①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物;可得装置J中发生反应的化学方程式为:PdCl2+CO+H2O=Pd+CO2+2HCl。
(7)因为Cl2和HCl都是酸性气体,故要证明经净化后的Cl2中不含HC1,必须利用Cl2易溶于有机溶剂的性质,实验过程为:将净化后的混合气体通入足量CCl4,再通过湿润的蓝色石蕊试纸(或湿润的pH试纸),试纸不变红(或通入AgNO3溶液,无白色沉淀生成),则证明净化后的Cl2中不含HCl。


科目:高中化学 来源: 题型:
【题目】利用液化石油气中的丙烷脱氢可制取丙烯:C3H8(g)![]() C3H6 (g)+H2 (g) △H。起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷的物质的量分数如图所示(已知pl为0.1 MPa)。
C3H6 (g)+H2 (g) △H。起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷的物质的量分数如图所示(已知pl为0.1 MPa)。
(1)反应的△H_________(填“>”“<”或“=’’,下同)

(2)以丙烯为燃料、熔融碳酸盐为电解质制作新型电池,放电时CO32-移向该电池的______(填“正极,或“负极”),当消耗2.8 L(标准状况)C3H6时,电路中转移电子的物质的量为__________。
(3)根据图中B点坐标计算,556℃时该反应酌平衡常数为______Pa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),若图中A、B两点对应的平衡常数用K(A)、K (B)表示,则K(A) _____(填“>” “<”或“=”)K(B)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
(1)W2-离子的结构示意图为______________,E元素在周期表中的位置为____________,写出E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式____________________。
(2)经测定A2W2为二元弱酸,A2W2的电子式为___________,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式__________________________。
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀成.当消耗2mol I﹣时,共转移3mol电子,该反应的离子方程式是_____________________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,写出该反应方程式______________________,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表里的四种短周期主族元素的相对位置如下所示。已知它们的原子序数总和为38,用元素符号回答以下问题:
m | n | x | |
y |
(1)元素n的原子序数为________;
(2) m、n、x第一电离能的由小到大的顺序:电负性的由大到小的顺序:________。(用元素符号表示)
(3)m、x按照1:2所形成化合物的电子式: ________,分子构型:_____;
(4)用以上任意两种元素写出一个含有极性键的5原子非极性分子式:___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的系统命名法为2, 5-二甲基-4乙基己烷
的系统命名法为2, 5-二甲基-4乙基己烷
B. 石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化
C. 总质量一定时,乙酸和葡萄糖无论以何种比例混合,完全燃烧消耗氧气的量相等
D. 可用石蕊落液来鉴别乙二醇、葡萄糖、乙酸的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有广阔的海岸线,海水综合利用大有可为.海水中Br﹣含量为65mgL﹣1,从海水中提取溴的工业流程如下:
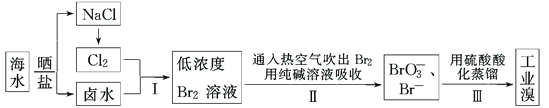
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是:_______.
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的___(填序号).
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
___Br2+___CO32﹣═___BrO3﹣+___Br﹣+___CO2↑
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.写出溴蒸气与二氧化硫水溶液反应的离子方程式:___________.
(5)实验室从溴水中分离出溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是____(填序号).
A.乙醇 B.四氯化碳 C.裂化汽油 D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅元素的化合物有多种。
回答下列问题:
(1)SiH4的沸点比CH4高,原因是____________________________________。
(2)硅与碳同主族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多。根据下表中 所列键能数据,简要分析可能的原因___________________________________。
化学键 | C—C | C—H | Si—Si | Si—H |
键能/(kJ·mol-1) | 356 | 413 | 226 | 318 |
氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在800℃的氮气气氛下合成:
3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(3)标出上述反应中电子转移的数目和方向____________。
(4)该反应的平衡常数表达式K=____________。已知平衡常数:K(800℃)>K(850℃),则反应是_________反应(填“放热”或“吸热”)。
(5)任写两种能提高二氧化硅转化率的措施_________________、_________________。
(6)一定温度下,在2L密闭容器内,充入一定量的反应物,5分钟时达到平衡,测得容器内气体增加了0.4mol,用CO表示该反应时间内的反应速率为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法正确的是( )
A. 离子晶体中一定含金属阳离子
B. 只要含有金属阳离子的晶体就一定是离子晶体
C. 在共价化合物分子中,各原子都形成8电子结构
D. 分子晶体的熔点不一定比金属晶体的熔点低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com