
【题目】利用液化石油气中的丙烷脱氢可制取丙烯:C3H8(g)![]() C3H6 (g)+H2 (g) △H。起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷的物质的量分数如图所示(已知pl为0.1 MPa)。
C3H6 (g)+H2 (g) △H。起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷的物质的量分数如图所示(已知pl为0.1 MPa)。
(1)反应的△H_________(填“>”“<”或“=’’,下同)

(2)以丙烯为燃料、熔融碳酸盐为电解质制作新型电池,放电时CO32-移向该电池的______(填“正极,或“负极”),当消耗2.8 L(标准状况)C3H6时,电路中转移电子的物质的量为__________。
(3)根据图中B点坐标计算,556℃时该反应酌平衡常数为______Pa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),若图中A、B两点对应的平衡常数用K(A)、K (B)表示,则K(A) _____(填“>” “<”或“=”)K(B)。
【答案】 > 负极 2.25 mol 1.25×104 <
【解析】(1)随着温度升高,丙烷的物质的量分数降低,说明升高温度平衡向正反应方向进行,因此反应的△H>0;(2)原电池中阴离子向负极移动,所以放电时CO32-移向该电池的负极;碳元素化合价从-2价升高到+4价,1mol丙烯失去18mol电子。标准状况下2.8L丙烯是2.8L÷22.4L/mol=0.125mol,转移电子是0.125mol×18=2.25mol。(3)根据方程式可知
C3H8(g)![]() C3H6(g)+H2(g)
C3H6(g)+H2(g)
起始量(mol) n 0 0
转化量(mol) m m m
平衡量(mol) n-m m m
![]()
解得n=3m
所以556℃时该反应的平衡常数为![]() 。正方应吸热,升高温度平衡向正反应方向进行,平衡常数增大,因此K(A)<K(B)。
。正方应吸热,升高温度平衡向正反应方向进行,平衡常数增大,因此K(A)<K(B)。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】下列分子或离子在指定的分散系中能大量共存的一组是( )
A. 银氨溶液:Na+、K+、NO3-、NH3·H2O
B. 空气:C2H2、CO2、SO2、NO
C. 氢氧化铁胶体:H+、K+、S2-、Br-
D. 高锰酸钾溶液:H+、Na+、SO42-、HCHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新报道:美国生物学家Joe Hanson博士测算出新生婴儿的化学式为:Co1Mo3 Se4 Cr7 F13 …C85,700,000 O132,000,000 H375,000,000(原子数目递增排序)。有关新生婴儿组成元素的说法正确的是( )

A. 全部为非金属元素 B. 全部由短周期元素组成
C. 原子序数越小其原子数目越多 D. 氧的质量分数大于氢的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于合金的叙述:①合金中至少含两种金属;②合金中的元素以化合物的形式存在;③合金中一定含金属;④合金一定是混合物。其中正确的是
A. ①②③④ B. ①③④ C. ②③④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家曾合成了一系列具有独特化学特性的(A1H3)n氢铝化合物。己知,最简单的氢铝化合物的分子式为A12H6,它的熔点为150 ℃,燃烧热极高。A12H6球棍模型如图。下列有关说法肯定错误的是

A. Al2H6在固态时所形成的晶体是分子晶体
B. 氢铝化合物可能成为未来的储氢材料和火箭燃料
C. Al2H6在空气中完全燃烧,产物为氧化铝和水
D. Al2H6中含有极性共价键、配位键和离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面图示回答问题:
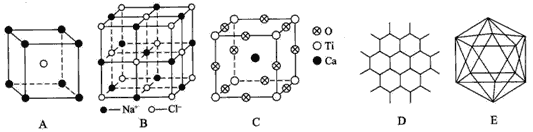
(1) A图是某离子化合物的晶胞,该化合物中阳、阴离子的个数比是______。
(2)B图表示NaCl晶体的一个晶胞,一个NaCl晶胞中含Na+或Cl-的个数均为____________。
(3)若Ca、Ti、O形成的某钙钛矿型晶体结构如C图,其化学式为____________。
(4)石墨晶体结构如D图所示,每一层由无数个正六边形构成,则平均每一个正六边形所占有的碳原子数和C-C键数之比为____________。
(5)原子晶体硼的基本结构单元都是由12个硼原子组成的正二十面体,如E图。其中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。若两个氮原子取代了其中的两个硼原子,形成B10N2,则该分子结构有__________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究“地康法制氯气”的原理并验证Cl2的性质,设计实验如下(夹持装置略去)请回答下列问题:
I. Cl2的制备。
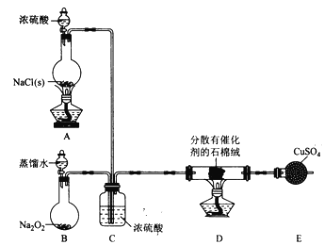
(1)装置B中发生反应的化学方程式为____________________。
(2)装置C的作用除干燥气体外还有_________________。
(3)装置 E中盛放CuSO4的仪器名称为_______________;反应开始后,硫酸铜变蓝,则装置D中发生反应的化学方程式为_____________________。
II. Cl2性质的验证。
该小组用实验I中制得的Cl2和如图所示装置(不能重复使用)依次验证干燥纯净的Cl2无漂白性、湿润的Cl2有漂白性、Cl的非金属性强于S
査阅资料:
①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物;
②少量CO2不干扰实验;
③该实验条件下,C与Cl2不反应。
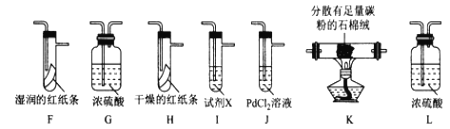
(4)按气流从左到右的方向,装置连接的合理顺序为E→__→__→__→__→__→__→__→尾气处理____________(填装置字母,)
(5)试剂X的名称为____________。
(6)装置J中发生反应的化学方程式为_________________。
(7)设计实验证明经净化后的Cl2中不含HC1:_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com