
【题目】关于合金的叙述:①合金中至少含两种金属;②合金中的元素以化合物的形式存在;③合金中一定含金属;④合金一定是混合物。其中正确的是
A. ①②③④ B. ①③④ C. ②③④ D. ③④
科目:高中化学 来源: 题型:
【题目】青少年在生长发育的旺盛时期,夜间容易出现腿部肌肉抽筋(抽搐)的现象,该现象产生的主要原因是血液中哪种物质浓度过低?
A. 水 B. 钙盐 C. NaCl D. HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL的某稀盐酸中滴入0.1 mol·L-1的氨水,溶液中由水电离出的氢离子浓度随滴人氨水体积的变化如图。下列分析不正确的是
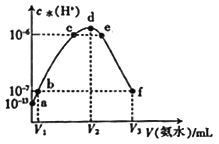
A. V2=20 mL
B. d点溶液中:c(NH4+)>c(Cl-)
C. b点溶液中:c(H+)=c(OH-)
D. 该稀盐酸的浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法不正确的是( )
A. 14gCnH2n中含有的氢原子数目为2NA
B. 14g乙烯和丙烯的混合物中含有共价键总数为3NA
C. 标准状况下,2.24 L CH2Cl2含有的分子数等于0.1 NA
D. 1molC10H22分子中共价键总数为31NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+XD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
3C(g)+XD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
(1)5min末A的物质的量浓度为______________mol/L·
(2)前5min内用B表示的化学反应速率v(B)为_________mol/(L·min)。
(3)化学方程式中X值为__________ 。
(4)此反应在四种不同情况下的反应速率分别为:①v(A)=5mol/(L·min);②v(B)=6mol/(L·min);③v(C)=4.5mol/(L·min);④v(D)=8mol/(L·min)。
其中反应速率最快的是__________(填编号)。
Ⅱ、(1)相对分子质量为72的烷烃,它的一氯代物只有一种,此烷烃的结构简式为_________。
(2)某气态烷烃和一气态烯烃组成的混合气体在同温、同压下对氢气的相对密度为13,取标准状况下此混合气体4.48 L,通入足量的溴水,溴水质量增加2.8 g,此两种烃的组成为______________(填分子式)。
(3) 有机物的结构可用“键线式”表示,如:![]() 可简写为
可简写为![]()
![]() 可简写为
可简写为 ![]() 。玫瑰的香味物质中包含苧烯,苧烯的键线式如右图,
。玫瑰的香味物质中包含苧烯,苧烯的键线式如右图, ,苧烯的分子式为___________。
,苧烯的分子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用液化石油气中的丙烷脱氢可制取丙烯:C3H8(g)![]() C3H6 (g)+H2 (g) △H。起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷的物质的量分数如图所示(已知pl为0.1 MPa)。
C3H6 (g)+H2 (g) △H。起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷的物质的量分数如图所示(已知pl为0.1 MPa)。
(1)反应的△H_________(填“>”“<”或“=’’,下同)

(2)以丙烯为燃料、熔融碳酸盐为电解质制作新型电池,放电时CO32-移向该电池的______(填“正极,或“负极”),当消耗2.8 L(标准状况)C3H6时,电路中转移电子的物质的量为__________。
(3)根据图中B点坐标计算,556℃时该反应酌平衡常数为______Pa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),若图中A、B两点对应的平衡常数用K(A)、K (B)表示,则K(A) _____(填“>” “<”或“=”)K(B)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列有机物中,互为同分异构体的是____。
A.葡萄糖和果糖 B.淀粉和纤维素 C.硬脂酸和软脂酸 D.甘氨酸和硝基乙烷
(2)芳香族化合物M( )是一种醇酸树脂,其合成路线如图所示,其中A的核磁共振氢谱有3组峰,F、G中均含有两种官能团。
)是一种醇酸树脂,其合成路线如图所示,其中A的核磁共振氢谱有3组峰,F、G中均含有两种官能团。

已知:R-CH2-CH=CH2![]()

(1)A的名称是_______________。
(2)M的链节中的官能团有______________。
(3)E的结构简式为______________,其核磁共振氢谱显示为____组峰,且峰面积之比为__________。
(4)鉴别F和G可选用的试剂为_____________。
(5)反应④的化学方程式为_____________。
(6)F的同分异构体中,符合下列条件的有______种(不包括立体异构),其中核磁共振氢谱的峰面积之比为1:2:2:2:1的是_______(填结构简式)。
a.能与FeCI3溶液发生显色反应
b.能发生水解反应
c.能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
(1)W2-离子的结构示意图为______________,E元素在周期表中的位置为____________,写出E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式____________________。
(2)经测定A2W2为二元弱酸,A2W2的电子式为___________,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式__________________________。
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀成.当消耗2mol I﹣时,共转移3mol电子,该反应的离子方程式是_____________________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,写出该反应方程式______________________,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_________L(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com