
【题目】常温下,向20 mL的某稀盐酸中滴入0.1 mol·L-1的氨水,溶液中由水电离出的氢离子浓度随滴人氨水体积的变化如图。下列分析不正确的是
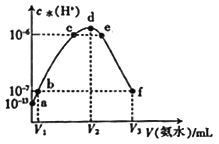
A. V2=20 mL
B. d点溶液中:c(NH4+)>c(Cl-)
C. b点溶液中:c(H+)=c(OH-)
D. 该稀盐酸的浓度为0.1mol/L
 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
【题目】如图所示,A是制取溴苯的实验装置,B、C是改进后的装置。请仔细分析,对比三个装置,回答下列问题:


(1)写出三个装置中发生反应的主要化学方程式:________________。写出B中右边试管中所发生反应的化学方程式:__________________。
(2)装置A和C均采用了长玻璃导管,其作用是_______、____________。
(3)在实验B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是________________;应对装置C进行的操作是_______________________。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是_________________。
(5)B中采用了洗气瓶吸收装置,其作用是______________________,反应后洗气瓶中可能出现的现象是_______________。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是_____________________;_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度 | ||
500℃ | 700℃ | 800℃ | ||
①2H2(g)+CO(g)CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g)H2O(g)+CO(g) | K2 | 1 | 1.7 | 2.52 |
③3H2(g)+CO2(g)CH3OH(g)+H2O(g) | K3 | |||
请回答下列问题:
(1)判断反应①是________(填“吸热”或“放热”)反应
(2)据据反应①与反应②可推导出K1、K2与K3之间的关系,则K3 =________(用K1、K2表示)
(3)某温度下反应①式中各物质的平衡浓度符合下式:20c(CH3OH) = 3c(CO)·c2(H2),试判断此时的温度为________。
(4)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为0.4 mol·L-1、1 mol·L-1、0.5 mol·L-1、0.4 mol·L-1,则此时ν(正)________ν(逆)(填“>”、“=”或“<”)。
(5)一定条件下将H2(g)和CO2(g)以体积比3:1置于恒温恒容的密闭容器发生反应③,下列能说明该反应达到平衡状态的有_____________
A.体系密度保持不变
B.H2和CO2的体积比保持不变
C.混合气体的平均相对分子量不变时,反应一定达到平衡状态
D.当破坏CO2中2个碳氧双键,同时破坏H2O 中的2个氧氢键,反应一定达到平衡状态
(6)若500℃时在2L密闭容器中加入2molH2和amolCO2进行②的反应,反应5min后达到平衡,平衡时CO2的转化率为50%,求a =________mol,用H2表示该反应达到平衡时的平均反应速率ν(H2) =________mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙烯和聚氯乙烯均能使溴水褪色,发生加成反应
B.丁烷(C4H10)和二氯甲烷都存在同分异构体
C.“地沟油”的主要成分是油脂,其成分与矿物油不同
D.淀粉,蛋白质,蔗糖都是能发生水解的高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新报道:美国生物学家Joe Hanson博士测算出新生婴儿的化学式为:Co1Mo3 Se4 Cr7 F13 …C85,700,000 O132,000,000 H375,000,000(原子数目递增排序)。有关新生婴儿组成元素的说法正确的是( )

A. 全部为非金属元素 B. 全部由短周期元素组成
C. 原子序数越小其原子数目越多 D. 氧的质量分数大于氢的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠、碳酸氢钠是日常生产生活中常用的两种盐。在实验室中制取NaHCO3的方法有多种。请
依据下列方法回答问题:
方法一:模拟工业“侯氏制碱法”制取:(原理NaCl+H2O+CO2+NH3 = NaHCO3↓+NH4Cl)
第一步:连接好装置,检验气密性,在仪器内装人药品。
第二步:让某一装置先发生反应,直到产生的气体不能再在Ⅲ中溶解,再通入另一装置中产生的气体,片刻后,Ⅲ中出现固体。继续向Ⅲ中通入两种气体,直到不再有固体产生。
第三步:分离Ⅲ中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。

(1)图中所示装置的连接顺序是:a接f;e接________;b接_________(填接口编号)。
(2)I中盛放稀盐酸的仪器名称是_____________,IV中应选用的液体为________________。
(3)第二步中让_____________ (填序号)装置先发生反应。
(4)第四步中所加固体粉末为________。所得的晶体中常含有少置的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4Cl。简要写出操作和现象______________________。
方法二:把CO2通人饱和Na2CO3溶液制取NaHCO3。装置如下图所示(气密性已检验,部分夹持装置略):

(5)请结合化学平衡移动原理解释B中溶液的作用_________________。
(6)当C中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(取一定量的固体,配成溶液作为样液,其余固体备用):
①方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是________________。
②方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于合金的叙述:①合金中至少含两种金属;②合金中的元素以化合物的形式存在;③合金中一定含金属;④合金一定是混合物。其中正确的是
A. ①②③④ B. ①③④ C. ②③④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的叙述中正确的是
A.所有的金属都是固态的
B.金属具有导电性、导热性和延展性
C.活泼的金属、或较活泼的金属能与酸反应,但不能与碱反应
D.金属元素在自然界中都是以化合态存在的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com