
����Ŀ����ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��
��ѧ��Ӧ | ƽ�ⳣ�� | �¶� | ||
500�� | 700�� | 800�� | ||
��2H2(g)+CO(g)CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
��H2(g)+CO2(g)H2O(g)+CO(g) | K2 | 1 | 1.7 | 2.52 |
��3H2(g)+CO2(g)CH3OH(g)+H2O(g) | K3 | |||
��ش��������⣺
��1���жϷ�Ӧ����________(����ȡ����ȡ�)��Ӧ
��2���ݾݷ�Ӧ���뷴Ӧ�ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3 =________(��K1��K2��ʾ)
��3��ij�¶��·�Ӧ��ʽ�и����ʵ�ƽ��Ũ�ȷ�����ʽ��20c(CH3OH) = 3c(CO)��c2(H2)�����жϴ�ʱ���¶�Ϊ________��
��4��500��ʱ��÷�Ӧ����ijʱ��H2(g)��CO2(g)��CH3OH(g)��H2O(g)��Ũ�ȷֱ�Ϊ0.4 mol��L-1��1 mol��L-1��0.5 mol��L-1��0.4 mol��L-1�����ʱ��(��)________��(��)(���������=������)��
��5��һ�������½�H2(g)��CO2(g)�������3:1���ں��º��ݵ��ܱ�����������Ӧ�ۣ�������˵���÷�Ӧ�ﵽƽ��״̬����_____________
A����ϵ�ܶȱ��ֲ���
B��H2��CO2������ȱ��ֲ���
C����������ƽ����Է���������ʱ����Ӧһ���ﵽƽ��״̬
D�����ƻ�CO2��2��̼��˫����ͬʱ�ƻ�H2O �е�2�����������Ӧһ���ﵽƽ��״̬
��6����500��ʱ��2L�ܱ������м���2molH2��amolCO2���Тڵķ�Ӧ����Ӧ5min��ﵽƽ�⣬ƽ��ʱCO2��ת����Ϊ50%����a =________mol����H2��ʾ�÷�Ӧ�ﵽƽ��ʱ��ƽ����Ӧ���ʦ�(H2) =________mol��L-1��min-1
���𰸡� ���� K1��K2 800 �� �� C��D 1 0.05
��������(1)��Ӧ���������¶ȣ�ƽ�ⳣ����С��˵�������¶ȣ�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ�
(2)��Ӧ��3H2(g)+CO2(g)�TCH3OH(g)+H2O(g)�����������С�ķ�Ӧ��S��0�����ݷ�Ӧ��+���õ���Ӧ��������ƽ�ⳣ��K3=K1��K2���ʴ�Ϊ��K1K2��
(3)20c(CH3OH) = 3c(CO)��c2(H2)����Ϊ![]() =K=
=K=![]() =0.15��˵���¶�Ϊ800�����ʴ�Ϊ��800 ����
=0.15��˵���¶�Ϊ800�����ʴ�Ϊ��800 ����
(4)��500����÷�Ӧ����ijʱ�̣�H2(g)��CO2(g)��CH3OH(g)��H2O(g)��Ũ�ȷֱ�Ϊ0.4 mol��L-1��1 mol��L-1��0.5 mol��L-1��0.4 mol��L-1�� Q=![]() =3.125��K=K1��K2=2.5����Ӧ������У�V����V�棬�ʴ�Ϊ������
=3.125��K=K1��K2=2.5����Ӧ������У�V����V�棬�ʴ�Ϊ������
(5)A����Ӧǰ���������������������䣬��ϵ�ܶ�ʼ�ձ��ֲ��䣬����˵���÷�Ӧ�ﵽƽ��״̬������B�����ݷ���ʽ��H2��CO2�������ʼ�ձ���3:1���䣬����˵���÷�Ӧ�ﵽƽ��״̬������C����Ӧ�����������ʵ�����С���������䣬��������ƽ����Է���������ƽ����Է���������ʱ����Ӧһ���ﵽƽ��״̬����ȷ��D�����ƻ�CO2��2��̼��˫����ͬʱ�ƻ�H2O �е�2���������˵�����淴Ӧ������ȣ���Ӧһ���ﵽƽ��״̬����ȷ����ѡCD��
(6) H2(g) + CO2(g) H2O(g) + CO(g)
��ʼ(mol)2 a 0 0
��Ӧ ![]()
![]()
![]()
![]()
ƽ�� 1-![]()
![]()
![]()
![]()
��K= =1�����a=1��ƽ��ʱ���������ʵ���Ϊ0.5mol��Ũ��Ϊ0.25mol/L����H2��ʾ�÷�Ӧ�ﵽƽ��ʱ��ƽ����Ӧ������(H2) =
=1�����a=1��ƽ��ʱ���������ʵ���Ϊ0.5mol��Ũ��Ϊ0.25mol/L����H2��ʾ�÷�Ӧ�ﵽƽ��ʱ��ƽ����Ӧ������(H2) =![]() =0.05mol��L-1��min-1���ʴ�Ϊ��1��0.05��
=0.05mol��L-1��min-1���ʴ�Ϊ��1��0.05��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������������Z�ֱ�ͨ����ʼ�����ͬ���ܱ�������(����)�͢�(��ѹ)�У�ʹ�䷢����Ӧ��t0ʱ�������дﵽ��ѧƽ�⣬X��Y��Z�����ʵ�����ʱ��ı仯��ϵ��ͼ��ʾ���������й��ƶ���ȷ���� (����)

A. �÷�Ӧ�Ļ�ѧ����ʽ��3X��2Y![]() 3Z
3Z
B. ���������о��ﵽƽ������V(��)<V(��)����������ﵽƽ������ʱ��С��t0
C. ���������о��ﵽƽ�����X��Y��Z��Ϊ��̬����Z�����������>��
D. ��ƽ������������������¶�ʱ���������˵��Z�����ķ�ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л�����������Ũ��ʱ��ͨ����������ɱ�����������ǣ� ��
A. ������ҺB. �Ҵ���ҺC. ��ȩ��ҺD. ������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڢٱ��Ӣڼױ������������ϩ���Ҵ��У�ѡ������д��
��1���ܺͽ����Ʒ�Ӧ�ų�H2����______����2������NaOH��Һ��Ӧ����______��
��3������������Ũ��ˮ��Ӧ����__����4����ʹ����KMnO4��Һ��ɫ������__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϸ���к����������ֻ����������е�Ԫ����
A. C��H��O B. C��H��O��N
C. O��H D. H��P
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Fe2(C2O4)3��xH2Oͨ����ش����������ˮ����������ˮ������110�����ȫʧȥ�ᾧˮ��Ϊ�ⶨ�þ��������ĺ����ͽᾧˮ�ĺ�����ijʵ��С����������ʵ�飺
����1������4.66g������������д��������Ƴ�250 mLһ�����ʵ���Ũ�ȵ���Һ��
����2��ȡ������Һ25.00 mL����ƿ�У���ϡH2SO4�ữ���μ�KMnO4��Һ�������
ǡ��ȫ�������ɶ�����̼��ͬʱMnO4-����ԭ��Mn2������Ӧ�����Һ�м���һС��п�ۣ���������Һ��ɫ�պ���ʧ�����ˡ�ϴ�ӣ������˼�ϴ��������Һ�ռ�����ƿ�У���ʱ��Һ�Գ����ԡ�
����3����0.0200 mol��L-1KMnO4��Һ�ζ�����2������Һ���յ㣬����KMnO4��ҺV1 mL���ζ���MnO4-����ԭ��Mn2����
�ظ�����2������3�IJ���2�Σ��ֱ�ζ�����0.0200 mol��L-1 KMnO4��ҺΪV2��V3 mL��
��¼�������±���
ʵ���� | KMnO4��Һ��Ũ�ȣ�mol��L-1�� | KMnO4��Һ����������mL�� |
1 | 0.0200 | V1 = 20.02 |
2 | 0.0200 | V2 = 20.12 |
3 | 0.0200 | V3 = 19.98 |
��ش��������⣺
��1����������Һ������ˮ����ԭ��_________________�������ӷ���ʽ��ʾ��
��2����ʵ�鲽��1�Ͳ���3��ʹ�õ�������������ƽ������̨���ζ��ܼС��ձ����������⣬һ���������������е�______________ (�����)
��ʽ�ζ��� B����ʽ�ζ��� C����Ͳ(10 mL) D����ƿ��
E����ͷ�ι� F��©�� G��250 mL����ƿ
��3������п�۵�Ŀ����______________________
��4������3�ζ�ʱ�Ƿ�ѡ��ָʾ��_________���ǻ��˵������_________________________д������3�з�����Ӧ�����ӷ���ʽ____________________________
��5���ڲ���2�У��������KMnO4��Һ�������������õ�������________(�ƫ�͡�����ƫ�ߡ����䡱)��ʵ���øþ����нᾧˮ�ĸ���xΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������ʢʱ�ڣ�ҹ�����׳����Ȳ�������鴤�������������������Ҫԭ����ѪҺ����������Ũ�ȹ��ͣ�
A. ˮ B. ���� C. NaCl D. HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20 mL��ijϡ�����е���0.1 mol��L-1�İ�ˮ����Һ����ˮ�������������Ũ������˰�ˮ����ı仯��ͼ�����з�������ȷ����
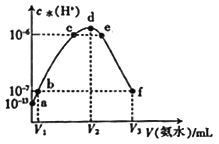
A. V2=20 mL
B. d����Һ�У�c(NH4+)>c(Cl-)
C. b����Һ�У�c(H+)=c(OH-)
D. ��ϡ�����Ũ��Ϊ0.1mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������л����У���Ϊͬ���칹�����____��
A�������Ǻ��� B�����ۺ���ά�� C��Ӳ֬�����֬�� D���ʰ������������
(2)�����廯����M( )��һ�ִ�����֬����ϳ�·����ͼ��ʾ������A�ĺ˴Ź���������3��壬F��G�о��������ֹ����š�
)��һ�ִ�����֬����ϳ�·����ͼ��ʾ������A�ĺ˴Ź���������3��壬F��G�о��������ֹ����š�

��֪:R-CH2-CH=CH2![]()

��1��A��������_______________��
��2��M�������еĹ�������______________��
��3��E�Ľṹ��ʽΪ______________����˴Ź���������ʾΪ____��壬�ҷ����֮��Ϊ__________��
��4������F��G��ѡ�õ��Լ�Ϊ_____________��
��5����Ӧ�ܵĻ�ѧ����ʽΪ_____________��
��6��F��ͬ���칹���У�����������������______�֣������������칹�������к˴Ź������ķ����֮��Ϊ1:2:2:2:1����_______����ṹ��ʽ����
a.����FeCI3��Һ������ɫ��Ӧ
b���ܷ���ˮ�ⷴӦ
c���ܷ���������Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com