
����Ŀ����ͼ��ʾ��A����ȡ�屽��ʵ��װ�ã�B��C�ǸĽ����װ�á�����ϸ�������Ա�����װ�ã��ش��������⣺


��1��д������װ���з�����Ӧ����Ҫ��ѧ����ʽ��________________��д��B���ұ��Թ�����������Ӧ�Ļ�ѧ����ʽ��__________________��
��2��װ��A��C�������˳��������ܣ���������_______��____________��
��3����ʵ��B��Cװ��������ҩƷ��Ҫʹ��Ӧ��ʼ��Ӧ��װ��B���еIJ�����________________��Ӧ��װ��C���еIJ�����_______________________��
��4��װ��B��C�Ϻõؽ����A�м�װҩƷ��ʹװ�ü�ʱ�ܷ��ì�ܣ������˲�����Aװ������һ������ʵ������ɵĺ����_________________��
��5��B�в�����ϴ��ƿ����װ�ã���������______________________����Ӧ��ϴ��ƿ�п��ܳ��ֵ�������_______________��
��6��Bװ��Ҳ�����������Ե�ȱ�㣬ʹʵ���Ч�����û����������С�������ȱ����_____________________��_____________________��
���𰸡� ![]() +Br2
+Br2 +HBr AgNO3+HBr=AgBr��+HNO3 ����HBr������������������ ��ת��Һ©���Ļ��� ʹ��ͱ��Ļ��Һ�ε������� ��������ʹ����������ͱ��Ļ��Һ�� Br2�ͱ��������ݳ�����Ⱦ���� ���շ�Ӧ����HBr�ݳ����������ͱ����� CCl4����ɫ��ɳ�ɫ ��HBr�ݳ����������ͱ��������ܻ�������Ӧ���У�ԭ�������ʵ� ���ڵ��ܲ���AgNO3��Һ�ж��ײ�������
+HBr AgNO3+HBr=AgBr��+HNO3 ����HBr������������������ ��ת��Һ©���Ļ��� ʹ��ͱ��Ļ��Һ�ε������� ��������ʹ����������ͱ��Ļ��Һ�� Br2�ͱ��������ݳ�����Ⱦ���� ���շ�Ӧ����HBr�ݳ����������ͱ����� CCl4����ɫ��ɳ�ɫ ��HBr�ݳ����������ͱ��������ܻ�������Ӧ���У�ԭ�������ʵ� ���ڵ��ܲ���AgNO3��Һ�ж��ײ�������
��������ʵ�������屽���õ��Լ���Һ��ͱ���������������ʵ��������õ����廯�������÷�Ӧ��һ�����ȷ�Ӧ�����ڷ�Ӧ�ﱽ���嶼���ӷ���Һ�壬�������ɵ��廯�������б�Ȼ����б������������Ϊ�˽����һ���⣬����һ��Ҫ������������װ�ý������������������������Ӧ���У�ͬʱҲ�����ԭ�ϵ������ʡ���Ȼ�����û����������װ�ã�Ҳ���Ը�����������ԭ�������Ȼ�̼���л��ܼ��������廯���е��������ͱ�����ֹ����Ŷ��廯��ļ��顣�廯���������Ȼ���Ҳ�Ǽ�������ˮ�����壬�ʲ��ܽ��廯������ֱ��ͨ��ˮ���Է���������ʵ���β���к��ж����壬Ӧ��β������װ�ã��Է�β����Ⱦ������
(1). ����װ���з�����Ӧ����Ҫ��ѧ����ʽ��![]() +Br2
+Br2 +HBr��B���ұ��Թ����ڼ������ɵ��廯�����壬��������Ӧ�Ļ�ѧ����ʽ��AgNO3+HBr=AgBr��+HNO3��
+HBr��B���ұ��Թ����ڼ������ɵ��廯�����壬��������Ӧ�Ļ�ѧ����ʽ��AgNO3+HBr=AgBr��+HNO3��
(2). װ��A��C�������˳��������ܣ��������ǵ���HBr�����������������á� (3). ��ʵ��B��Cװ��������ҩƷ��Ҫʹ��Ӧ��ʼ��Ӧ��װ��B���еIJ�������ת��Һ©���Ļ���ʹ��ͱ��Ļ��Һ�ε������ϣ�Ӧ��װ��C���еIJ�������������ʹ����������ͱ��Ļ��Һ�С�
(4). װ��B��C�Ϻõؽ����A�м�װҩƷ��ʹװ�ü�ʱ�ܷ��ì�ܣ������˲�����Aװ������һ������ʵ������ɵĺ����Br2�ͱ��������ݳ�����Ⱦ������
(5). B�в�����ϴ��ƿ����װ�ã������������շ�Ӧ����HBr�ݳ����������ͱ���������Ӧ��ϴ��ƿ�п��ܳ��ֵ�������CCl4����ɫ��ɳ�ɫ��
(6). Bװ��Ҳ�����������Ե�ȱ�㣬ʹʵ���Ч�����û����������С�������ȱ������HBr�ݳ����������ͱ��������ܻ�������Ӧ���У�ԭ�������ʵͣ����ڵ��ܲ���AgNO3��Һ�ж��ײ���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����12�����屽��һ�ֳ��õĻ���ԭ�ϣ�ͨ���Ա�����Ϊԭ����ȡ��������֪��
�� | �� | �屽 | |
�ܶ�/g��cm��3 | 0��88 | 3��10 | 1��50 |
�е�/�� | 80 | 59 | 156 |
��ˮ�е��ܽ�� | �� | �� | �� |
ʵ�����Ʊ��屽��ʵ�鲽�����£�
����1����a�м���15 mL����������м���ٽ�b��4��0 mLҺ���������뵽a�С�
����2����ַ�Ӧ����a�м���10 mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����3����Һ������10 mLˮ��8 mL 10%��NaOH��Һ��10 mL ˮϴ�ӣ���Һ�ô��屽��
����4����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����˼��ôֲ�Ʒ��

��1������1����a�з�������Ҫ��ѧ��Ӧ����ʽΪ�� ��
��2������c��������������������������Ҫ�����У� ��
��3������3��NaOH����������Ҫ��Ӧ�ǣ� ��
��4������ͼ1���߿ָ�Ϊͼ2װ�ã��� D��E���Լ�������������� �������Թ�C�б��������� ���ܷ�ݴ��жϷ�����ȡ����Ӧ�� ����������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������������Z�ֱ�ͨ����ʼ�����ͬ���ܱ�������(����)�͢�(��ѹ)�У�ʹ�䷢����Ӧ��t0ʱ�������дﵽ��ѧƽ�⣬X��Y��Z�����ʵ�����ʱ��ı仯��ϵ��ͼ��ʾ���������й��ƶ���ȷ���� (����)

A. �÷�Ӧ�Ļ�ѧ����ʽ��3X��2Y![]() 3Z
3Z
B. ���������о��ﵽƽ������V(��)<V(��)����������ﵽƽ������ʱ��С��t0
C. ���������о��ﵽƽ�����X��Y��Z��Ϊ��̬����Z�����������>��
D. ��ƽ������������������¶�ʱ���������˵��Z�����ķ�ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.CO2��ת��һֱ��ȫ���о����ȵ㣬���н�CO2��H2�ϳɼ״��������� (CH3OCH3)�߱���Գ���ļ�������ҵ�����У���������ط�Ӧ
��CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l) ��H < 0
CH3OH(l) + H2O(l) ��H < 0
��2 CH3OH(l) ![]() CH3OCH3(g) + H2O(l) ��H < 0
CH3OCH3(g) + H2O(l) ��H < 0
��CO(g) + H2O(l) ![]() CO2(g) + H2(g) ��H < 0
CO2(g) + H2(g) ��H < 0
��1����һ���º��ݵ��ܱ������У�����һ�����ļ״����ʽ����ƽ�⣬����˵����ȷ��������Ϊ�÷�Ӧ�ﵽƽ��״̬���ж�����Ϊ________��
A��������������Է����������ֲ���
B������������ѹǿ����
C����ͬʱ�������ļ״����������Ķ����ѵ�������
D���״��Ͷ��������ʵ������
��2�������������ͬ���ܱ�����A,B,C�м�����ͬ���ʵ�����CO��H2O�ڲ�ͬ�¶��·�����Ӧ�ۣ�������ͬʱ����������е�CO���ʵ������¶ȵĹ�ϵ����ͼ��

�� A��B��������ʴ�Сv(A)___v(B)������ڡ�����С�ڡ��������ڡ��������жϡ���
�� �����������CO�����ʵ����ȼ�С�������ԭ��________________________��
��3��һ������CO2��H2��һ�ܱ������з�����Ӧ�٣�����ͼ��������CO2�İٷֺ���������������ı�ı仯����ͼ���벹����������t1ʱ�����£�t2ʱ�̼Ӵ�����______
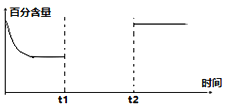

��.SO2��β������ͨ���õ绯ѧ������
��4����������ͼ��ʾ��Pt(��)�缫�ķ�ӦʽΪ__________________��
�ڵ���·��ת��0.02mole��ʱ(��ŨH2SO4��δ�ų�)������Ĥ�����Һ��Լ����_____mol���ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС��Ϊ��̽������ĵ������������������ʵ�顣
ʵ��һ ���Ʋ��궨������Һ��Ũ��
ȡ����������250 mL 0.2 mol/L������Һ����0.2 mol/L�Ĵ�����Һϡ�ͳ�����Ũ�ȵ���Һ������NaOH����Һ�����������Һ��Ũ�Ƚ��б궨���ش��������⣺
��1������250 mL 0.2 mol/L������Һʱ��Ҫ�õ��IJ�����������Ͳ���ձ�������������ͷ�ιܺ� ��
��2��Ϊ�궨ij������Һ��ȷŨ�ȣ���0.2000 mol/L NaOH��Һ��20.00 mL������Һ���еζ�����̪��ָʾ���������εζ�����NaOH��Һ��������£�
ʵ����� | 1 | 2 | 3 | 4 |
����NaOH��Һ�������ml�� | 20.05 | 20.00 | 18.80 | 19.95 |
��ô�����Һ��ȷŨ��Ϊ mol/L��������С�������λ��
��3���жϵζ��յ�ķ����� ��
��4�����в����п���ʹ���������Һ��Ũ����ֵƫ�͵��� ������ĸ��ţ���
A����ʽ�ζ���δ�ñ�Һ��ϴ��ֱ��ע���Һ
B���ζ�ǰʢ�Ŵ�����Һ����ƿ������ˮϴ����û�и���
C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D����ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
ʵ��� ̽��Ũ�ȶԴ������̶ȵ�Ӱ��
��pH�Ʋⶨ25��ʱ��ͬŨ�ȵĴ����pH��������£�
����Ũ�ȣ�mol��L��1�� | 0.0010 | 0.0100 | 0.0200 | 0.1000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 |
��5�����ݱ������ݣ����Եó�������������ʵĽ��ۣ�����Ϊ�ó��˽��۵������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������NaOH��Һ����μ���AlCl3��Һ�����ɳ���Al��OH��3������AlCl3�������ı仯��ϵ��ͼ��ʾ���������������ڶ�Ӧ����Һ��һ���ܴ���������ǣ� ��

A. a���Ӧ����Һ�У�Na+��Fe3+��SO42����HCO3��
B. b���Ӧ����Һ�У�Na+��S2����SO42����Cl��
C. c���Ӧ����Һ�У�Ag+��Ca2+��NO3����Na+
D. d���Ӧ����Һ�У�K+��NH4+��I����HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л�����������Ũ��ʱ��ͨ����������ɱ�����������ǣ� ��
A. ������ҺB. �Ҵ���ҺC. ��ȩ��ҺD. ������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڢٱ��Ӣڼױ������������ϩ���Ҵ��У�ѡ������д��
��1���ܺͽ����Ʒ�Ӧ�ų�H2����______����2������NaOH��Һ��Ӧ����______��
��3������������Ũ��ˮ��Ӧ����__����4����ʹ����KMnO4��Һ��ɫ������__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20 mL��ijϡ�����е���0.1 mol��L-1�İ�ˮ����Һ����ˮ�������������Ũ������˰�ˮ����ı仯��ͼ�����з�������ȷ����
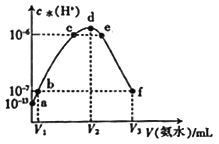
A. V2=20 mL
B. d����Һ�У�c(NH4+)>c(Cl-)
C. b����Һ�У�c(H+)=c(OH-)
D. ��ϡ�����Ũ��Ϊ0.1mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com