
【题目】Ⅰ.CO2的转化一直是全球研究的热点,其中将CO2和H2合成甲醇及二甲醚 (CH3OCH3)具备相对成熟的技术。工业生产中,有以下相关反应
①CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l) △H < 0
CH3OH(l) + H2O(l) △H < 0
②2 CH3OH(l) ![]() CH3OCH3(g) + H2O(l) △H < 0
CH3OCH3(g) + H2O(l) △H < 0
③CO(g) + H2O(l) ![]() CO2(g) + H2(g) △H < 0
CO2(g) + H2(g) △H < 0
(1)在一常温恒容的密闭容器中,放入一定量的甲醇如②式建立平衡,以下说法正确并可以作为该反应达到平衡状态的判断依据为________。
A.容器内气体相对分子质量保持不变
B.容器内气体压强不变
C.相同时间内消耗甲醇的量是消耗二甲醚的两倍;
D.甲醇和二甲醚物质的量相等
(2)在三个体积相同的密闭容器A,B,C中加入相同物质的量的CO和H2O在不同温度下发生反应③,经过相同时间后测得容器中的CO物质的量与温度的关系如下图:

① A、B两点的速率大小v(A)___v(B)(填“大于”、“小于”、“等于”、“无法判断”)
② 请解释曲线中CO的物质的量先减小后增大的原因________________________。
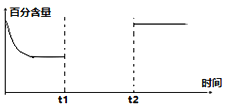
(3)一定量的CO2和H2在一密闭容器中发生反应①,下左图是容器内CO2的百分含量随着外界条件改变的变化曲线图,请补充完整。(t1时刻升温;t2时刻加催化剂)______

Ⅱ.SO2的尾气处理通常用电化学处理法
(4)①如上右图所示,Pt(Ⅱ)电极的反应式为__________________;
②当电路中转移0.02mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加_____mol离子。
【答案】 BC 小于 B容器的反应温度比A容器高,反应速率快,在相同时间内消耗掉CO多,而C容器中温度高,速率快,反应达到平衡后随温度上升平衡逆向移动,CO的量增大  2HSO3-+2e-+2H+=S2O42-+2H2O 0.03
2HSO3-+2e-+2H+=S2O42-+2H2O 0.03
【解析】(1)A.容器内气体只有二甲醚,相对分子质量一直保持不变,A错误;B.正反应体积增加,容器内气体压强不变说明反应达到平衡状态,B正确;C.相同时间内消耗甲醇的量是消耗二甲醚的两倍,说明正逆反应速率相等,达到平衡状态,C正确;D.甲醇和二甲醚物质的量相等不能说明正逆反应速率相等,所以不能证明达到了化学平衡状态,D错误,答案选BC。
(2)①B点温度高于A点,则A、B两点的速率大小v(A)<v(B)。②由于B容器的反应温度比A容器高,反应速率快,在相同时间内消耗掉CO多,而C容器中温度高,速率快,反应达到平衡后随温度上升平衡逆向移动,CO的量增大,因此曲线中CO的物质的量先减小后增大。(3)t1时升高温度,平衡向正反应方向移动,CO2的百分含量增加,因此图象为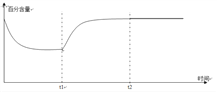 。(4)①根据装置图可知Pt(Ⅱ)电极产生S2O42-,发生得到电子的还原反应,反应式为2HSO3-+2e-+2H+=S2O42-+2H2O;②左侧电极反应式为:SO2-2e-+2H2O=SO42-+4H+,根据电子转移守恒,生成硫酸根物质的量0.02mol/2=0.01mol,生成氢离子为0.04mol,为保持溶液电中性,0.01mol硫酸根需要0.02mol氢离子,多余的氢离子通过阳离子交换膜移至右侧,即有0.02mol氢离子移至右侧,故左侧溶液中增加离子为0.01mol+0.02mol=0.03mol。
。(4)①根据装置图可知Pt(Ⅱ)电极产生S2O42-,发生得到电子的还原反应,反应式为2HSO3-+2e-+2H+=S2O42-+2H2O;②左侧电极反应式为:SO2-2e-+2H2O=SO42-+4H+,根据电子转移守恒,生成硫酸根物质的量0.02mol/2=0.01mol,生成氢离子为0.04mol,为保持溶液电中性,0.01mol硫酸根需要0.02mol氢离子,多余的氢离子通过阳离子交换膜移至右侧,即有0.02mol氢离子移至右侧,故左侧溶液中增加离子为0.01mol+0.02mol=0.03mol。


科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
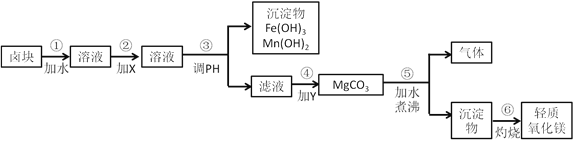
要求产品尽量不含杂质,而且生产成本较低,请根据表中提供的资料,回答下列问题。

(1)在步骤②中加入的试剂X,最佳的选择是______,其作用是__________;
(2)在步骤④中加入的试剂Y是_______________________;
(3)在步骤⑤中发生反应的化学方程式是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应8NH3+3Cl2=N2+6NH4Cl,下列说法正确的是( )
A.N2是还原产物
B.Cl2是氧化剂
C.还原剂与氧化剂物质的量之比是3:2
D.还原产物与氧化产物物质的量之比是1 : 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.选择合适的图象,用字母填空:

(1)将等质量的两份锌粉a、b分别加入过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系的图像是_______。
(2)将(1)中的CuSO4溶液改成CH3COONa溶液,其他条件不变,则图象是_______。
Ⅱ.Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的高效水处理剂,其电解制法如下图所示。电解过程中,两极均有气体产生,Y极区域溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍澄清。查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。

(3)电解过程中,X极区溶液的pH______(填“增大”“减小”或“不变”)。
(4)电解过程中,Y极发生的电极反应为___________和_____________。
(5)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少__________g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为2K2FeO4+3Zn===Fe2O3+ZnO+2K2ZnO2。该电池正极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们常用“往伤口上撒盐”来比喻某些人趁人之危的行为,从化学的角度说,“往伤口上撒盐”的做法并无不妥,甚至可以说并不是害人而是救人。这种做法的化学原理是( )
A.胶体的电泳 B.胶体的聚沉
C.血液中发生复分解反应 D.血液的氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀
B.司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金
C.聚酯纤维、碳纤维、光导纤维都属于有机高分子材料
D.石蜡油受热分解产生了可以使酸性高锰酸钾溶液褪色的烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A是制取溴苯的实验装置,B、C是改进后的装置。请仔细分析,对比三个装置,回答下列问题:


(1)写出三个装置中发生反应的主要化学方程式:________________。写出B中右边试管中所发生反应的化学方程式:__________________。
(2)装置A和C均采用了长玻璃导管,其作用是_______、____________。
(3)在实验B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是________________;应对装置C进行的操作是_______________________。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是_________________。
(5)B中采用了洗气瓶吸收装置,其作用是______________________,反应后洗气瓶中可能出现的现象是_______________。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是_____________________;_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:

O3的分子结构
(1)臭氧与氧气的关系是___________。
(2)选出下列分子中与O3分子属于等电子体的是 。
A.H2O B.CO2 C.SO2 D.BeCl2
(3)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有_______ 对孤对电子。
(4)O3与O2间的转化是否为氧化还原反应___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙烯和聚氯乙烯均能使溴水褪色,发生加成反应
B.丁烷(C4H10)和二氯甲烷都存在同分异构体
C.“地沟油”的主要成分是油脂,其成分与矿物油不同
D.淀粉,蛋白质,蔗糖都是能发生水解的高分子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com